Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

-Coi X là hỗn hợp của Fe và O2
\(n_{Fe}=\dfrac{m}{M}=\dfrac{8,4}{56}=0,15mol\)
\(n_{O_2}=xmol\)
\(n_{NO_2}=\dfrac{v}{22,4}=\dfrac{2,24}{22,4}=0,1mol\)
Fe\(\rightarrow Fe^{3+}+3e\)
0,15\(\rightarrow\)............0,45
O2\(+4e\rightarrow2O^{-2}\)
x\(\rightarrow\)4x
\(N^{+5}+1e\rightarrow N^{+4}\)
..............0,1\(\leftarrow\)0,1
-Bảo toàn e: 4x+0,1=0,45\(\rightarrow\)4x=0,35\(\rightarrow\)x=0,0875mol
\(m=m_{Fe}+m_{O_2}=8,4+0,0875.32=11,2gam\)

Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeO}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+72b=15,6\) (2)
Bảo toàn electron: \(3n_{Fe}+n_{FeO}=3n_{NO}\) \(\Rightarrow3a+b=0,45\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,105\\b=0,135\end{matrix}\right.\)
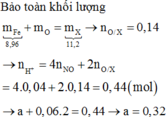



tác dụng với NO
Fe+2 ➜ Fe+3 +1e N+5 + 3e ➜ N+2
0,03←0,01
⇒ nFeO = 0,03/1 =0,03 mol
sau khi tác dụng với CO oxit sắt bị khử vậy rắn B là Fe, khi tác dụng với HNO3 toàn bộ sắt đều lên Fe+3
Fe → Fe+3 + 3e N+5 + 3e ➜ N+2
từ phương trình ta có nFe = nNO = 0,034 mol
mặt khác nFe = nFe(trong FeO) + nFe(trong Fe2O3)
= nFeO + 2nFe2O3
⇒ nFe2O3 = 0,002 mol