Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

à, mà mình tìm trên yahoo, thấy có câu trả lời nè bạn:
Chất rắn Y gồm Cu và Al dư ... gọi x là số mol Cu và y là số mol Al trong dung dịch Y
Cu -> Cu+2 + 2e
Al -> Al+3 +3e
O +2e-> O-2
chọn a = 32 gam -> ne trao đổi = 1,4 mol
{2x + 3y = 1,4
{64x + 27y = 32
-> x = 97/230 g
-> m Cu = 97.64/230 = 27 g -> %Cu = 27.100/32 = 84%

Chất rắn Y gồm Cu và Al dư ... gọi x là số mol Cu và y là số mol Al trong dung dịch Y
Cu -> Cu+2 + 2e
Al -> Al+3 +3e
O +2e-> O-2
chọn a = 32 gam -> ne trao đổi = 1,4 mol
{2x + 3y = 1,4
{64x + 27y = 32
-> x = 97/230 g
-> m Cu = 97.64/230 = 27 g -> %Cu = 27.100/32 = 84%
Gọi x là số mol Cu và y là số mol Al trong dung dịch Y
Cu -> Cu+2 + 2e
Al -> Al+3 +3e
O +2e-> O-2
chọn a = 32 gam -> ne trao đổi = 1,4 mol
{2x + 3y = 1,4
{64x + 27y = 32
-> x = 97/230 g
-> m Cu = 97.64/230 = 27 g -> %Cu = 27.100/32 = 84%

Chất rắn Y gồm Cu và Al dư ... gọi x là số mol Cu và y là số mol Al trong dung dịch Y
Cu -> Cu+2 + 2e
Al -> Al+3 +3e
O +2e-> O-2
chọn a = 32 gam -> ne trao đổi = 1,4 mol
{2x + 3y = 1,4
{64x + 27y = 32
-> x = 97/230 g
-> m Cu = 97.64/230 = 27 g -> %Cu = 27.100/32 = 84%


→ nH2 = 0,03
Al2S3 + 6HCl → 2AlCl3 + 3H2S↑
0,01 ← 0,03
2Al + 6HCl → 2AlCl3 + 3H2↑
→ nH2 = 0,03 → nAl = 0,02
2Al + 3S → Al2S3
Pư: 0,02 0,03 ←0,01
Dư: 0,02 0,00125
Bđ: 0,04 0,03125
=> %Al = 51,92%
%S = 48,08%


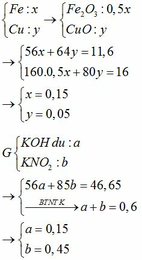
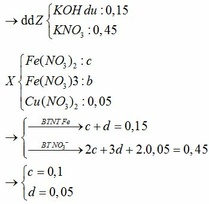

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

Phản ứng nhiệt nhôm:
2 A l + F e 2 O 3 → t 0 A l 2 O 3 + 2 F e ( 1 )
Phần 1 tác dụng với dung dịch NaOH dư không sinh ra khí → hỗn hợp B không có Al dư. Vậy hỗn hợp B gồm A l 2 O 3 , Fe và có thể có F e 2 O 3 dư.
4,4 gam chất rắn không tan có thể gồm Fe và F e 2 O 3 d ư
Phần 2: tác dụng với H 2 S O 4 loãng dư → chỉ có Fe phản ứng sinh ra khí
n H 2 = 1,12 22,4 = 0,05
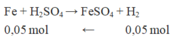
Khối lượng F e 2 O 3 dư ở phần 2 = 4,4 – mFe = 4,4 – 0,05.56 = 1,6 gam.
n F e 2 O 3 p u b d đ = 2. 1 2 . n F e ( p 2 ) = 0,05 m o l
Khối lượng F e 2 O 3 ban đầu: 0,05.160 + 1,6.2 = 11,2 gam.
⇒ Chọn B.

\(n_{CuO}=n_{Cu}=\dfrac{4}{80}=0,05mol\\ n_{H_2}=0,4mol\\ n_{Al}=a;n_{Zn}=b\\ 27a+65b=15,1-0,05\cdot64\\ BTe^-:3a+2b=2\cdot0,4\\ a=0,2;b=0,1\\ m_{ddHCl}=\dfrac{\left(0,6+0,2\right)\cdot36,5}{0,2}=146g\)

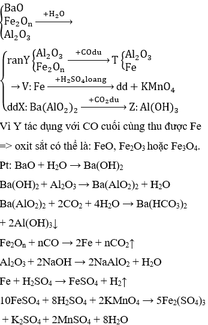
Giả sử a(g) chất rắn X chỉ có Cu
Suy ra $n_{Cu}=\frac{a}{64}(mol)=n_{CuO}$
Do đó $m_{CuO}=1,25a(g)< 1,36a$ (Vô lý)
Do đó trong X phải có Al