Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
%mO/X = 86,3×0,1947 = 16,8 gam.
⇒ nO = 1,05 ⇒ nAl2O3 = 0,35 mol.
Ta có ∑nOH– = 2nH2 = 1,2 mol.
⇒ Dung dịch Y chứa nAlO2– = nAl/Al2O3 = 0,7 mol || nOH dư = 0,5 mol.
+ Sau phản ứng trung hòa nH+ = 3,2×0,75 – 0,5 = 1,9 mol
⇒ nAl(OH)3 = 0,7 – 1 , 9 - 0 , 7 3 = 0,3 mol.
⇒ mRắn = mAl2O3 = 0 , 3 × 102 2 = 15,3 gam

Giải thích:
mO(X)=86,3.19,47/100=16,8 gam=>nO(X)=1,05 mol=>nAl2O3=nO(X)/3=0,35 mol.
nOH-=2nH2=1,2 mol.
nHCl=3,2.0,75=2,4 mol.
Al2O3+2OH-→2AlO2- +H2O
0,35 0,7 0,7(mol)
Y gồm: 0,5 mol OH- dư, 0,7 mol AlO2-
H+ + OH-→H2O
0,5←0,5 (mol)
H+ + AlO2- + H2O→Al(OH)3↓
0,7←0,7→ 0,7 (mol)
Al(OH)3↓+3H+→Al3++3H2O
0,4←2,4-0,5-0,7=1,2 (mol)
nAl(OH)3=0,7-0,4=0,3 mol =>m↓=0,3.78=23,4 g.
Đáp án A

Đáp án D
Theo đề bài ta có
![]()
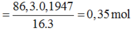
Khi hòa tan hỗn hợp X bằng nước.Xét dung dịch Y ta có :
![]()
![]()
![]()
- Khi cho dung dịch Y tác dụng với 2,4 mol HCl, vì:
![]()

![]()

Đáp án A
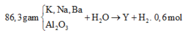
Từ số mol H2 ta tính được số mol O H - giải thích
![]()
![]()
![]() , mà
A
l
2
O
3
→
3
O
, mà
A
l
2
O
3
→
3
O
→ n A l 2 O 3 = 0 , 35 m o l
⇒ n O H - = 2 n H 2 = 1 , 2 m o l
Ta có phương trình:
![]()
=> dung dịch Y gồm

⇒ kết tủa A l ( O H ) 3
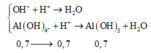
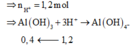
=> Số mol kết tủa còn lại là:
![]()

Giải thích:
mO=103,56.20/100=20,712 gam => nO=1,2945 mol => nAl2O3=nO/3=0,4315 mol
nOH-=2nH2=6 mol
Al2O3+2OH-→2AlO2-+H2O
0,4315…0,863….0,863
=>Y gồm: 0,863 mol AlO2-; 6-0,863=5,137 mol OH- dư
Khi cho 5,5 mol H+ vào Y:
OH-+H+→H2O
5,137..5,137
H++AlO2-+H2O→Al(OH)3
0,363..0,363………0,363
m=0,363.78=28,314 gam
Đáp án D

Quy hỗn hợp về Na, Ba, O có số mol lần lượt là a;b;c(mol)
Theo gt ta có: $n_{Na}=0,2(mol);n_{H_2}=0,15(mol);n_{H_2SO_4}=0,12(mol)$
Bảo toàn e ta có: $0,2+2b-2c=0,3$
Mặt khác $137b+16c=22,15$
Giải hệ ta được $b=0,15;c=0,1$
Do đó $n_{OH^-}=0,5(mol)$
$2OH^-+CO_2\rightarrow CO_3^{2-}+H_2O$
$CO_3^{2-}+CO_2+H_2O\rightarrow 2HCO_3^-$
Sau phản ứng dung dịch Z chứa 0,4 mol $HCO_3^-$; 0,1 mol $Ba^{2+}$ và 0,2 mol $Na^+$
Khi nhỏ $H_2SO_4$ vào dung dịch thì $\Rightarrow m=23,3(g)$
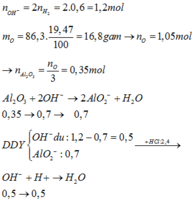
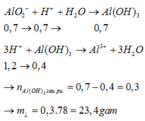

Đáp án cần chọn là: A