Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi như hỗn hợp X chỉ gồm Na, K, Ba, O
Cho X vào nước thì 3 kim loại phản ứng sinh ra khí H2, còn O tác dụng với H2 để tạo ra nước theo tỷ lệ 1Oxi+1H2
\(\Rightarrow\) \(n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_O=0,14\left(mol\right)\)
Có \(n_{Na}=n_{NaOH}=0,18\left(mol\right)\)
\(n_K=n_{KOH}=\frac{0,044m}{56};n_{Ba}=n_{Ba\left(OH\right)_2}=\frac{0,93m}{171}\left(mol\right)\)
\(\Rightarrow n_O=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_{H_2}=0,09+\frac{0,022m}{56}+\frac{0,465m}{171}\)
Lại có phương trình tổng khối lượng hỗn hợp X:
\(m_X=m=m_{Na}+m_K+m_{Ba}+m_O\\ =0,18.23+\frac{0,044m}{56}.39+\frac{0,93m}{171}.137+m_O\)
Thay số mol Oxi tính được (theo m) ở trên vào ta được phương trình 1 ẩn m
giải ra được \(m\approx25,5\)

Giải thích:
mO(X)=86,3.19,47/100=16,8 gam=>nO(X)=1,05 mol=>nAl2O3=nO(X)/3=0,35 mol.
nOH-=2nH2=1,2 mol.
nHCl=3,2.0,75=2,4 mol.
Al2O3+2OH-→2AlO2- +H2O
0,35 0,7 0,7(mol)
Y gồm: 0,5 mol OH- dư, 0,7 mol AlO2-
H+ + OH-→H2O
0,5←0,5 (mol)
H+ + AlO2- + H2O→Al(OH)3↓
0,7←0,7→ 0,7 (mol)
Al(OH)3↓+3H+→Al3++3H2O
0,4←2,4-0,5-0,7=1,2 (mol)
nAl(OH)3=0,7-0,4=0,3 mol =>m↓=0,3.78=23,4 g.
Đáp án A

Đáp án D
Theo đề bài ta có
![]()
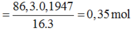
Khi hòa tan hỗn hợp X bằng nước.Xét dung dịch Y ta có :
![]()
![]()
![]()
- Khi cho dung dịch Y tác dụng với 2,4 mol HCl, vì:
![]()

![]()

Đáp án A
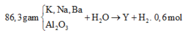
Từ số mol H2 ta tính được số mol O H - giải thích
![]()
![]()
![]() , mà
A
l
2
O
3
→
3
O
, mà
A
l
2
O
3
→
3
O
→ n A l 2 O 3 = 0 , 35 m o l
⇒ n O H - = 2 n H 2 = 1 , 2 m o l
Ta có phương trình:
![]()
=> dung dịch Y gồm

⇒ kết tủa A l ( O H ) 3
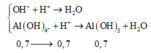
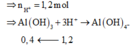
=> Số mol kết tủa còn lại là:
![]()
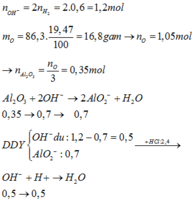
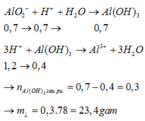

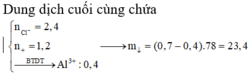
Giải thích:
mO=103,56.20/100=20,712 gam => nO=1,2945 mol => nAl2O3=nO/3=0,4315 mol
nOH-=2nH2=6 mol
Al2O3+2OH-→2AlO2-+H2O
0,4315…0,863….0,863
=>Y gồm: 0,863 mol AlO2-; 6-0,863=5,137 mol OH- dư
Khi cho 5,5 mol H+ vào Y:
OH-+H+→H2O
5,137..5,137
H++AlO2-+H2O→Al(OH)3
0,363..0,363………0,363
m=0,363.78=28,314 gam
Đáp án D