Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt số mol Fe3O4 là x (mol)
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
x..............8x..........2x............x
Cu + 2FeCl3 ⟶ 2FeCl2 + CuCl2
x.........2x................2x.............x
Kim loại không tan là Cu
Dung dịch Y gồm FeCl2, CuCl2 và HCl dư
=> \(n_{FeCl_2}=x+2x=3x\left(mol\right);n_{CuCl_2}=x\left(mol\right)\)
\(n_{OH^-}=0,5.1+0,5.1=1\left(mol\right)\)
\(H^+_{\left(dư\right)}+OH^-\rightarrow H_2O\)
\(Fe^{2+}+2OH^-\rightarrow Fe\left(OH\right)_2\)
3x..........6x...............3x
\(Cu^{2+}+2OH^-\rightarrow Cu\left(OH\right)_2\)
x.............2x.................x
Kết tủa là Cu(OH)2 và Fe(OH)2
Ta có : \(3x.90+x.98=36,8\)
=> x=0,1 (mol)
=> \(m_{Cu}=x.64+1,6=8\left(g\right)\)
=> \(m=0,1.232+8=31,2\left(g\right)\)
Mặt khác : \(n_{HCl\left(dư\right)}=1-\left(6x+2x\right)=0,2\left(mol\right)\)
=> \(n_{HCl\left(bđ\right)}=8x+0,2=1\left(mol\right)\)

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
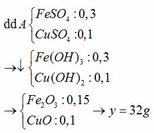

Đặt mol của FeO, Cu, Fe2O3 lần lượt là x, y, z (mol)
- Khi cho X phản ứng với HCl vừa đủ thu được dd Y gồm 2 chất tan → Y chứa FeCl2 và CuCl2
FeO + 2 HCl → FeCl2 + H2O
x → x
Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O
z → 2z
2 FeCl3 + Cu → CuCl2 + 2 FeCl2
2z → z → z → 2z
Vì Cu phản ứng vừa đủ với FeCl3 nên ta có z = y (1)
Dung dịch Y chứa FeCl2 (x + 2z mol) và CuCl2 (z mol)
- Khi cho dd Y tác dụng với AgNO3 dư:
FeCl2 + 3AgNO3 → 2AgCl + Ag + Fe(NO3)3
(x+2z) → 2(x+2z) → (x+2z)
CuCl2 + 2AgNO3 → 2 AgCl + Cu(NO3)2
z → 2z
⟹ mkết tủa AgCl, Ag = 143,5.(2x + 6z) + 108.(x + 2z) = 36,8 (2)
Y{FeCl2;CuCl2}+NaOHdu−−→↓{Fe(OH)2;Cu(OH)2}Nung−−→Chatran{Fe2O3;CuO}Y{FeCl2;CuCl2}→+NaOHdu↓{Fe(OH)2;Cu(OH)2}→NungChatran{Fe2O3;CuO}
Bảo toàn nguyên tố Fe ⟹ nFe2O3 = 1/2.nFeO + nFe2O3 = 0,5x + z (mol)
Bảo toàn nguyên tố Cu ⟹ nCuO = nCu = y (mol)
⟹ mchất rắn = 160.(0,5x + z) + 80y = 8 (3)
Giải hệ (1) (2) (3) được x = 0,025; y = 0,025; z = 0,025
⟹ m = 0,025.72 + 0,025.64 + 0,025.160 = 7,4 gam
- Mặt khác cho X phản ứng với H2SO4 đặc:
Quá trình trao đổi e:
Fe+2 → Fe+3 + 1e S+6 + 2e → S+4 (SO2)
Cu0 → Cu+2 + 2e
Áp dụng bảo toàn e: nFeO + 2nCu = 2nSO2 ⇔ 0,025 + 2.0,025 = 2.nSO2 ⇔ nSO2 = 0,0375 mol
⟹ V = 0,0375.22,4 = 0,84 lít

Đặt \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Na_2SO_3}=y\left(mol\right)\end{matrix}\right.\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
x ---> x ----------> x -------> x
\(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+SO_2\)
y -----------> y -----------> y ------------------> y
Có: \(d_Y=13,4.2=26,8\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow\dfrac{m_Y}{n_Y}=26,8\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow\dfrac{2x+64y}{x+y}=26,8\)
\(\Rightarrow\dfrac{x}{y}=1,5\Leftrightarrow x-1,5y=0\left(1\right)\)
Mặt khác có: \(n_Y=x+y=0,02\left(2\right)\)
Từ (1), (2) giải được: \(\left\{{}\begin{matrix}x=0,012\\y=0,008\end{matrix}\right.\)
\(m=m_{Fe}+m_{Na_2SO_3}=56x+126y=56.0,012+126.0,008=1,68\left(g\right)\)
\(m_{dd.H_2SO_4}=\dfrac{\left(0,012+0,008\right).98.100\%}{20\%}=9,8\left(g\right)\)
\(m_{dd}=1,68+9,8-2.0,012-64.0,008=10,944\left(g\right)\)
\(C\%_{FeSO_4}=\dfrac{152.0,012.100\%}{10,944}=16,67\%\)
\(C\%_{Na_2SO_4}=\dfrac{142.0,008.100\%}{10,944}=10,38\%\)

Đặt CT chung 3 KL là R có hóa trị chung là n
\(PTHH:4R+nO_2\xrightarrow{t^o}R_2O_n\\ R_2O_n+nH_2SO_4\to R_2(SO_4)_n+nH_2O\\ \Rightarrow n_{H_2SO_4}=n_{H_2O}\\ \text {Bảo toàn KL: }m_{R_2O_n}+m_{H_2SO_4}=m_{R_2(SO_4)_3}+m_{H_2O}\\ \Rightarrow 2,8+98n_{H_2SO_4}=6,8+18n_{H_2SO_4}\\ \Rightarrow n_{H_2SO_4}=0,05(mol)\\ \Rightarrow V=V_{dd_{H_2SO_4}}=\dfrac{0,05}{1}=0,05(l)=50(ml)\\ \text {Ta có: }n_{O_2}=\dfrac{n_{R_2O_3}}{2}.n;n_{R_2O_3}=\dfrac{n_{H_2SO_4}}{n}\\ \Rightarrow n_{O_2}=\dfrac{n_{H_2SO4}}{2}=0,025(mol)\\ \Rightarrow m_{O_2}=0,025.32=0,8(g)\\ \text {Bảo toàn KL: }m=m_R+m_{O_2}=m_{R_2O_n}\\ \Rightarrow m=m_R=2,8-0,8=2(g)\)


Đặt a,b là số mol Fe3O4 và Cu
=> %O = \(\dfrac{16\cdot4a}{232a+64b}=25,8\%\)
bảo toàn e
a+2b=5.0,006.10
=> a=0,1997 và b=0,0501
=> m=49,54(gam)