Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
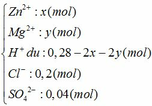
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
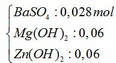
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

CT chung A+2nH2SO4-->A2(SO4)n+nSO2+2nH2O
0.035/n 0.035 (mol)
A2(SO4)n-->A2On
0.035/n 0.035/n
mr=mA+(0.035/n)*n*16=2g
trắc nghiệm nSO42-=nSO2=0.035
BTĐT( chất rắn nên tự luận ko ghi được):nO2-=nSO42-=0.035
mr=mA+mO2-=2
A+2nH2SO4-->A2(SO4)n+nSO2+2nH2O
0.035/n 0.035 (mol)
A2(SO4)n-->A2On
0.035/n 0.035/n
mr=mA+(0.035/n)*n*16=2g
trắc nghiệm nSO42-=nSO2=0.035
BTĐT( chất rắn nên tự luận ko ghi được):nO2-=nSO42-=0.035
mr=mA+mO2-=2
#GG

Gọi n lá hóa trị của M
Gọi $n_{Fe} = a(mol) ; n_M = b(mol)$
$\Rightarrow 56a + Mb = 10,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$2M + 2nHCl \to 2MCl_n + nH_2$
Theo PTHH :
$n_{H_2} = a + 0,5bn = \dfrac{6,72}{22,4} = 0,3(2)$
Bảo toàn nguyên tố với Fe,M
$n_{Fe_2O_3} = 0,5a(mol)$
$n_{M_2O_n} = 0,5b(mol)$
Ta có :
0,5a.160 + 0,5b(2M + 16n) = 16(3)
Từ (1)(2)(3) suy ra a = 0,1 ; Mb = 4,8 ; bn = 0,4 => b = 0,4/n
Suy ra :
$M = Mb : b = 4,8 : 0,4/n = 12n$
Với n = 2 thì M = 24(Magie)
$n_{FeCl_2} = a = 0,1(mol)$
$n_{MgCl_2} = n_{Mg} = 0,4 : n = 0,4 : 2 = 0,2(mol)$
Vậy :
$m_{FeCl_2} = 0,1.127 = 12,7(gam)$
$m_{MgCl_2} = 0,2.95 = 19(gam)$

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
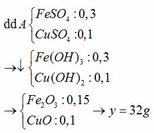



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

a) Nhận xét: 33,84g X > 16g rắn → kim loại còn dư.
Chú ý: sau một thời gian ám chỉ các chất tham gia đều dư.
Giả sử số mol của Mg, Fe lần lượt là x, y
Tăng giảm khối lượng: (64 – 24) . x + (64 – 56) . y = 38,24 – 33,84 (1)
Chất rắn bao gồm MgO: x; Fe2O3: 0,5y; CuO: a – x – y
=> 40x + 160 . 0,5y + 80(a – x – y) = 16 (2)
Từ (1) và (2) => 10a + y = 2,55
amax <=> y = 0 => amax = 0,255
b) giá trị a đạt max thì Fe chưa tham gia pứ.
Giả sử số mol Mg dư là: z (mol) 19,12g Z cho 0,48 mol SO2 → 38,24g Z cho 0,96 mol SO2
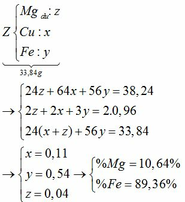

mdd giảm = m↓ - mCO2 → mCO2 = 10 - 3,4 = 6,6 gam → nCO2 = 6,6 : 44 = 0,15 mol.
C6H12O6 enzim−−−−→30−35oC→30-35oCenzim2C2H5OH + 2CO2
Theo phương trình: nC6H12O6 = 0,15 : 2 = 0,075 mol.
Mà H = 90% → nC6H12O6 = 0,075 : 90% = 1/12 mol → m = 180 x 1/12 = 15 gam



Đặt mol của FeO, Cu, Fe2O3 lần lượt là x, y, z (mol)
- Khi cho X phản ứng với HCl vừa đủ thu được dd Y gồm 2 chất tan → Y chứa FeCl2 và CuCl2
FeO + 2 HCl → FeCl2 + H2O
x → x
Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O
z → 2z
2 FeCl3 + Cu → CuCl2 + 2 FeCl2
2z → z → z → 2z
Vì Cu phản ứng vừa đủ với FeCl3 nên ta có z = y (1)
Dung dịch Y chứa FeCl2 (x + 2z mol) và CuCl2 (z mol)
- Khi cho dd Y tác dụng với AgNO3 dư:
FeCl2 + 3AgNO3 → 2AgCl + Ag + Fe(NO3)3
(x+2z) → 2(x+2z) → (x+2z)
CuCl2 + 2AgNO3 → 2 AgCl + Cu(NO3)2
z → 2z
⟹ mkết tủa AgCl, Ag = 143,5.(2x + 6z) + 108.(x + 2z) = 36,8 (2)
Y{FeCl2;CuCl2}+NaOHdu−−→↓{Fe(OH)2;Cu(OH)2}Nung−−→Chatran{Fe2O3;CuO}Y{FeCl2;CuCl2}→+NaOHdu↓{Fe(OH)2;Cu(OH)2}→NungChatran{Fe2O3;CuO}
Bảo toàn nguyên tố Fe ⟹ nFe2O3 = 1/2.nFeO + nFe2O3 = 0,5x + z (mol)
Bảo toàn nguyên tố Cu ⟹ nCuO = nCu = y (mol)
⟹ mchất rắn = 160.(0,5x + z) + 80y = 8 (3)
Giải hệ (1) (2) (3) được x = 0,025; y = 0,025; z = 0,025
⟹ m = 0,025.72 + 0,025.64 + 0,025.160 = 7,4 gam
- Mặt khác cho X phản ứng với H2SO4 đặc:
Quá trình trao đổi e:
Fe+2 → Fe+3 + 1e S+6 + 2e → S+4 (SO2)
Cu0 → Cu+2 + 2e
Áp dụng bảo toàn e: nFeO + 2nCu = 2nSO2 ⇔ 0,025 + 2.0,025 = 2.nSO2 ⇔ nSO2 = 0,0375 mol
⟹ V = 0,0375.22,4 = 0,84 lít