Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

N+5 +1e =>N+4
0,02 mol<=0,02 mol
2N+5 +2.4e =>2N+1
0,04 mol<=0,01 mol
ne nhận=ne nhường=0,06 mol
nNO3- tạo muối=ne nhận=0,06 mol
=>mNO3-=0,06.62=3,72g
mKL=5,04g=>m muối=m gốc KL+mNO3-=3,72+5,04=8,76g
nHNO3 =0,06+0,02+0,005.2=0,09 mol
=>CM dd HNO3=0,09/0,1=0,9M
Phương trình nhận electron:
N+5 + 8e → N2O
N+5 +1e→NO2
nNO tạo muối = nNO + 8nN2O = 0,02 + 8.0,005 = 0.02 + 0,04 = 0,06 mol
mNO tạo muối =0,06.62 = 3,72g
m =mKL+ mNO tạo muối = 5,04 + 3,72 = 8,76g
nHNO3 tham gia phản ứng = 2nNO + 10nN2O = 2.0,02 + 10.0,005= 0,09 mol
x =0.09:0,1=0,9M ==>> Đáp án thứ nhất

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Xem hỗn hợp ban đầu được tạo thành từ: Fe, Cu và O2
Fe -------> Fe3+ + 3e
x.........................3x
Cu -------> Cu2+ + 2e
y..........................2y
O2 + 4e -----> 2O2-
z.........4z
S+6 + 2e -------> S+4
...........0,045..........0,0225
Gọi x, y, z là số mol Fe, Cu, O2. Ta có hệ gồm 3 pt:
56x + 64y + 32z = 2,44
3x + 2y = 4z + 0,045
0,5*400x + 160y = 6,6
=> x = 0,025, y = 0,01, z = 0,0125
=> %mCu = 0,01*64/2,44*100% = 26,23%

Đáp án A
Nếu Fe có hóa trị không đổi ta có sơ đồ quá trình
15,6 gam (M, M2On) + (H2SO4, NaNO3) → (N2O: 0,01 mol; NO: 0,02 mol) + H2O + (Mn+, Na+, SO42− -+BaSO4 → 89,15 gam (M(OH)n, BaSO4)
bảo toàn N có: nNaNO3 = 0,04 mol. gọi nO trong oxit = x mol.
bỏ cụm SO4 2 vế, bảo toàn nguyên tố O có nH2O = x + 0,09 mol.
bảo toàn H có nH2SO4 = (x + 0,09) mol. Theo đó, 89,15 gam kết tủa gồm:
15,6 – 16x) gam M + 2x + 0,09 × 2 – 0,04Na+ mol OH và (x + 0,09) mol BaSO4.
⇒ giải x = 0,2 mol. Xét tiếp phản ứng nung 89,15 gam kết tủa:
2M(OH)n → M2On + nH2O (đơn giản: 2OH → 1O + 1H2O).
⇒ mchất rắn sau nung = 89,15 – 0,27 × 18 = 84,29 gam < 84,386 theo giả thiết.
→ FeSO4 → Fe(OH)2 → FeO mà thực tế: 2FeO + O → Fe2O3.
⇒ nFeO = 2 × 84,386 – 84,29) ÷ 16 = 0,012 mol ⇄ nFeSO4 = 0,012 mol.
Lại có mX = 15,6 + 200 – 0,01 × 44 – 0,02 × 30 = 214,56 gam
⇒ C%FeSO4 trong X = 0,012 × 152 ÷ 214,56 × 100% ≈ 0,85%.
 với các chất sau:
với các chất sau: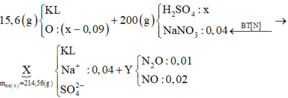
Đáp án A
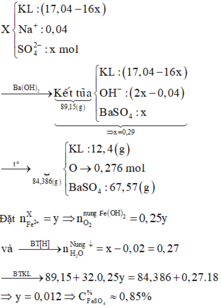
Bảo toàn N => nNaNO3 = 2nN2O + nNO = 0,04
Đặt nH2SO4 = a và nO trong hỗn hợp ban đầu = b
=> nH+ = 2a = 2b + 0,01.10 + 0,02.4 (1 )
nBa(OH)2 = nBaSO4 = a
nNaOH = nNaNO3 = 0,04
Bảo toàn OH- => nOH trong↓ = 2a - 0,04
=> m↓ = 233a + (15,6 - 16b) + 17(2a - 0,04) = 89,15 (2)
(1)(2) => a = 0,29 và b = 0,2
Đặt nFe2+ = c
Bảo toàn electron => nO2 phản ứng với↓= 0,25c
Bảo toàn H => nH2O khi nung ↓ = a - 0,02 = 0,27
m rắn = 89,15 + 32.0,25c - 18.0,27 = 84,386
=>c = 0,012
mdd X= 15,6 + 200 - mY = 214,56
=> C%FeSO4 = 0 , 012 . 152 214 , 56 . 100% = 0,85%