Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

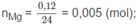
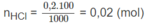
Mg + 2HCl → M g C l 2 + H 2
1 2 (mol)
0,005 0,01 mol
Số mol HCl còn lại sau phản ứng: 0,02 - 0,01 = 0,01 (mol).
Từ đó, số mol HCl trong 1000 ml là 0,1 mol, nghĩa là sau phản ứng
[HCl] = 0,1M = 1. 10 - 11 . 10 - 1 M.
Vậy pH = 1.

a)
$n_{CaCO_3} = 0,12(mol) ; n_{HCl} = 0,6(mol)
\(CaCO_3+2HCl\text{→}CaCl_2+CO_2+H_2O\)
Ban đầu 0,12 0,6 (mol)
Phản ứng 0,12 0,24 (mol)
Sau pư 0 0,36 0,12 (mol)
$V = 0,12.22,4 = 2,688(lít)$
b)
$n_{Cl^-} = 0,6(mol) ; n_{H^+} = 0,36(mol)$
$n_{Ca^{2+}} = 0,12(mol)$
$[Cl^-] = \dfrac{0,6}{0,2} = 3M$
$[H^+] = \dfrac{0,36}{0,2} = 1,8M$
$[Ca^{2+}] = \dfrac{0,12}{0,2} = 0,6M$
a,\(n_{CaCO_3}=\dfrac{12}{100}=0,12\left(mol\right);n_{HCl}=0,2.3=0,6\left(mol\right)\)
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Mol: 0,12 0,12
Ta có: \(\dfrac{0,12}{1}< \dfrac{0,6}{2}\)⇒ HCl dư,CaCO3 pứ hết
\(V_{CO_2}=0,12.22,4=2,688\left(l\right)\)

Thêm HCl đến khi xuất hiện kết tủa tức là trong dd còn có NaOH dư
NaOH + HCl = NaCl + H2O
Mol NaOH dư = 1/2 mol Na2O => mNa2O = 0,05x62 = 3,1g => Hỗn hợp còn lại có khối lượng = 16,4g
2NaOH + Al2O3 = 2NaAlO2 + H2O
Gọi mol NaOH phản ứng với Al2O3 = 2x => mol Al2O3 = x mol
Ta có 62x + 102x = 16,4g => x = 0,1 mol => Mol Al2O3 = 0,1 mol; Mol Na2O = 0,15 mol
%nAl2O3 = 40%
%nNa2O = 60%

a)
Coi V dd HCl = 100(ml)
m dd HCl = 1,25.100 = 125(gam)
n HCl = 125.7,3%/36,5 = 0,25(mol)
[H+ ] = [Cl- ] = CM HCl = 0,25/0,1 = 2,5M
b)
n Al = 0,235(mol)
2Al + 6HCl $\to$ 2AlCl3 + 3H2
n HCl pư = 3n Al = 0,705(mol)
n HCl dư = 0,4.2 - 0,705 = 0,095(mol)
[H+ ] = CM HCl dư = 0,095/0,4 = 0,2375M
pH = -log([H+ ]) = 0,624

\(n_{HCl\left(3\right)}=0,35.0,4=0,14\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}0,1.V_1+0,5.V_2=0,14\\V_1+V_2=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}V_1=0,15\\V_2=0,25\end{matrix}\right.\)

\(n_{H^+}=0,5.0,2=0,1\left(mol\right)\)
\(n_{OH^-}=0,5.0,3=0,15\left(mol\right)\)
\(\Rightarrow n_{OH^-dư}=0,15-0,1=0,05\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]_{\text{sau pư}}=\dfrac{0,05}{0,5}=0,1\)
\(\Rightarrow\left[H^+\right]=10^{-13}\)
\(\Rightarrow pH=13\)
