Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 56y = 5,5 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{5,5}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)

Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)

Gọi nFe = a (mol); nAl = b (mol)
=> 56a + 27b = 11 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Fe + 2HCl -> FeCl2 + H2
a ---> 2a ---> a ---> a
2Al + 6HCl -> 2AlCl3 + 3H2
b ---> 1,5b ---> b ---> b
=> a + 1,5b = 0,4 (2)
Từ (1)(2) => a = 0,1 (mol); b = 0,15 (mol)
mFe = 0,1 . 56 = 5,6 (g)
mAl = 0,2 . 27 = 5,4 (g)
THAM KHẢO :
Fe + 2HCl -> FeCl2 + H2 (1)
a) 2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Gọi khối lượng Fe là x(g) (0<x<11) => nFe = x/56 (mol)
Thì mAl là 11-x(g) => nAl = (11-x)/27 (mol)
nH2 = 8,96/22,4 = 0,4 (mol)
Theo PT (1) ta có: nH2 = nFe = x/56 (mol)
Theo PT (2) ta có: nH2 = 3/2 nAl = 3/2 . (11-x)/27 = (11-x)/18 (mol)
Theo đề bài, nH2 thu được là 0,4(mol) nên ta có:
x/56 + (11-x)/18 = 0,4
<=> 18x +56(11-x) = 403,2
<=> x = 5,6 (g)
Do đó: mFe = 5,6(g) => nFe = 5,6/56 = 0,1 (mol)
mAl = 11-5,6 = 5,4(g) => nAl = 5,4/27 = 0,2 (mol)

PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
a, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{0,4}{2,5}=0,16\left(l\right)\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 56y = 8 (1)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=x+y\left(mol\right)\)
⇒ x + y = 0,2 (2)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Fe}=5,6\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

Sửa đề : Xác định kim loại Z biết rằng 500ml dung dịch HCl 1M hòa tan dư 4,8g kim loại đó
nH2=0,05 mol
PTHH:
Fe+2HCl→FeCl2+H2↑
Z + 2HCl →ZCl2+H2↑
Đặt công thức chung của hỗn hợp là N
N + 2HCl → NCl2 + H2
0,05______________0,05
⇒MN=\(\dfrac{2}{0,05}\)=40
Vì MFe =56>40
⇒MZ <40 (1)
Ta có : nHCl<0,5.1=0,5 mol
Z + 2HCl →ZCl2+H2↑
=> nZ < 0,25
=> MZ >\(\dfrac{4,8}{0,25}=19,2\)(2)
Từ (1), (2), ta có 19,2<MZ <40
Mà Z hóa trị II
⇒Z là Magie
dạ em cảm ơn nhưng nếu đề cho thêm 1M thì em cũng làm được ạ! em chỉ muốn mọi người xác nhận xem đề chuẩn chưa thoi ạ

\(a.n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ a............3a.......a.........1,5a\left(mol\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ b.........2b........b.........b\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}27a+56b=5,5\\1,5a+b=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{27.0,1}{5,5}.100\approx49,091\%\\\%m_{Fe}=\dfrac{0,05.56}{5,5}.100\approx50,909\%\end{matrix}\right.\\ b.C_{MddHCl}=\dfrac{3a+2b}{0,5}=\dfrac{3.0,1+2.0,05}{0,5}=0,8\left(M\right)\)
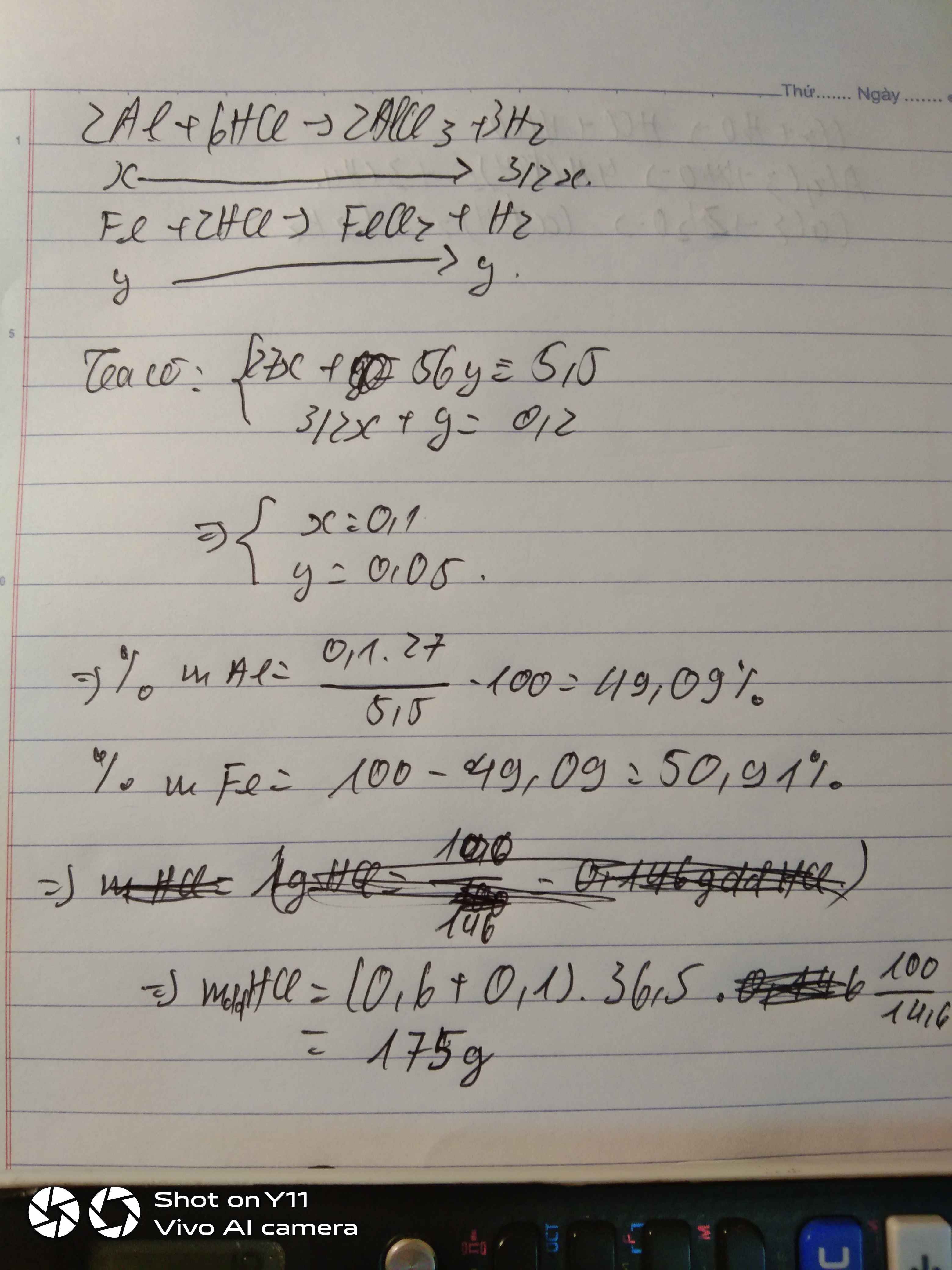
câu hỏi??????
2Al + 6HCl \(\rightarrow\)2AlCl3 + 3H2 (1)
Fe + 2HCl \(\rightarrow\)FeCl2 + H2 (2)
nH2=\(\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Đặt nAl=a\(\Leftrightarrow m_{Al}=27a\)
nFe=b\(\Leftrightarrow m_{Fe}=56b\)
Ta có hệ pt:
\(\left\{{}\begin{matrix}27a+56b=5,5\\\dfrac{3}{2}a+b=0,2\end{matrix}\right.\)
Giải hệ ta có:
a=0,1;b=0,05
mAl=27.0,1=2,7(g)
C% Al=\(\dfrac{2,7}{5,5}.100\%=49\%\)
C% Fe=100-49=51%
b;\(\sum\)nHCl=0,1.3+0,05.2=0,4(mol)
CMHCl=\(\dfrac{0,4}{0,5}=0,8M\)