Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
b)
n CuO = 2,8/80 = 0,035(mol)
n H2SO4 = 140.20%/98 = 2/7 (mol)
Ta thấy :
n CuO / 1 < n H2SO4 /1 nên H2SO4 dư
n H2SO4 pư = n CuO = 0,035(mol)
=> m H2SO4 dư = 140.20% - 0,035.98 = 24,57(gam)
c)
m dd = m CuO + m dd H2SO4 = 2,8 + 140 = 142,8(gam)
C% CuSO4 = 0,035.160/142,8 .100% = 3,92%
C% H2SO4 = 24,57/142,8 .100% = 17,2%

\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{200\cdot39.2\%}{98}=0.8\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Lập tỉ lệ :
\(\dfrac{0.2}{2}< \dfrac{0.8}{3}\) => H2SO4 dư
\(n_{H_2}=\dfrac{3}{2}\cdot0.2=0.3\left(mol\right)\)
\(V_{H_2}=0.3\cdot22.4=6.72\left(l\right)\)
\(m_{dd}=5.4+200-0.3\cdot2=204.8\left(g\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0.1\cdot342=34.2\left(g\right)\)
\(C\%_{Al_2\left(SO_4\right)_3}=\dfrac{34.2}{204.8}\cdot100\%=16.7\%\)

\(n_{NaOH}=\dfrac{m}{M}=\dfrac{4}{40}=0,1mol\)
\(n_{H_2SO_4}=\dfrac{9,8}{98}=0,1mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(\dfrac{0,1}{2}\) < \(\dfrac{0,1}{1}\) ( mol )
0,1 0,05 ( mol )
Chất còn dư là H2SO4
Chất phản ứng hết là NaOH
\(m_{Na_2SO_4}=n.M=0,05.142=7,1g\)
nNaOH = 4/40 = 0,1 (mol)
nH2SO4 = 9,8/98 = 0,1 (mol)
PTHH: 2NaOH + H2SO4 -> Na2SO4 + H2O
LTL: 0,1/2 < 0,1 => H2SO4 dư
nNa2SO4 = 0,1/2 = 0,05 (mol)
mNa2SO4 = 0,05 . 142 = 7,1 (g)

a) PTHH: \(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{BaCO_3}=\dfrac{68,95}{197}=0,35\left(mol\right)\\n_{HCl}=0,25\cdot3,2=0,8\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,35}{1}< \dfrac{0,8}{2}\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow n_{HCl\left(dư\right)}=0,8-0,35\cdot2=0,1\left(mol\right)\) \(\Rightarrow m_{HCl\left(dư\right)}=0,1\cdot36,5=3,65\left(g\right)\)
b+c) Theo PTHH: \(\left\{{}\begin{matrix}n_{CO_2}=n_{BaCl_2}=0,35\left(mol\right)\\n_{HCl\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,35\cdot22,4=7,84\left(l\right)\\C_{M_{BaCl_2}}=\dfrac{0,35}{0,25}=1,4\left(M\right)\\C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,25}=0,4\left(M\right)\end{matrix}\right.\)

\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
4P + 5O2 \(\underrightarrow{t^o}\) 2P2O5
\(\dfrac{0,1}{4}< \dfrac{0,2}{5}\) => O2 dư, Photpho đủ
\(n_{O_2}=0,2-0,04=0,16\left(mol\right)\)
\(m_{P_2O_5}=\) 0,05 . 142 = 7,1 ( g )

1.
nAl=\(\dfrac{5,4}{27}\)=0,2 mol
mHCl=\(\dfrac{175.14,6}{100}\)=25,55g
nHCl=\(\dfrac{25,55}{36,5}\)=0,7
2Al + 6HCl → 2AlCl3 + 3H2↑
n trước pứ 0,2 0,7
n pứ 0,2 →0,6 → 0,2 → 0,3 mol
n sau pứ hết dư 0,1
Sau pứ HCl dư.
mHCl (dư)= 36,5.0,1=3,65g
mcác chất sau pư= 5,4 +175 - 0,3.2= 179,8g
mAlCl3= 133,5.0,2=26,7g
C%ddHCl (dư)= \(\dfrac{3,65.100}{179,8}=2,03%\)%
C%ddAlCl3 = \(\dfrac{26,7.100}{179,8}\)= 14,85%
2.
200ml= 0,2l
mMg= \(\dfrac{4,2}{24}=0,175mol\)
Mg + 2HCl → MgCl2 + H2↑
0,175→ 0,35 → 0,175→0,175 mol
a) VH2= 0,175.22,4=3,92l.
b)C%dHCl= \(\dfrac{0,35}{0,2}=1,75\)M

\(n_{Zn}=\dfrac{1,625}{65}=0,025mol\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,025 < 0,1 ( mol )
0,025 0,05 0,025 0,025 ( mol )
\(V_{H_2}=0,025.22,4=0,56l\)
Chất dư là HCl
\(m_{HCl\left(dư\right)}=\left(0,1-0,05\right).36,5=1,825g\)
\(m_{ZnCl_2}=0,025.136=3,4g\)
huhu cảm ơn bạn đề dài quá nên đưa lên đây làm giúp

ta có: nAl=5,4:27=0,2 mol
nS=6,4:32=0,2 mol
PTHH: 2Al + 3S \(\rightarrow\) Al2S3
ban đầu: 0,2 0,2 (mol)
phản ứng: 0,2 \(\leftarrow\) 0,2 (mol)
sau PƯ: 0 0 \(\frac{1}{15}\) (mol)
vậy sau phản ứng Al dư, S hết ( nhưng do cùng số mol nên Al hết)
mAL2S3= \(\frac{1}{15}.150=10\left(g\right)\)
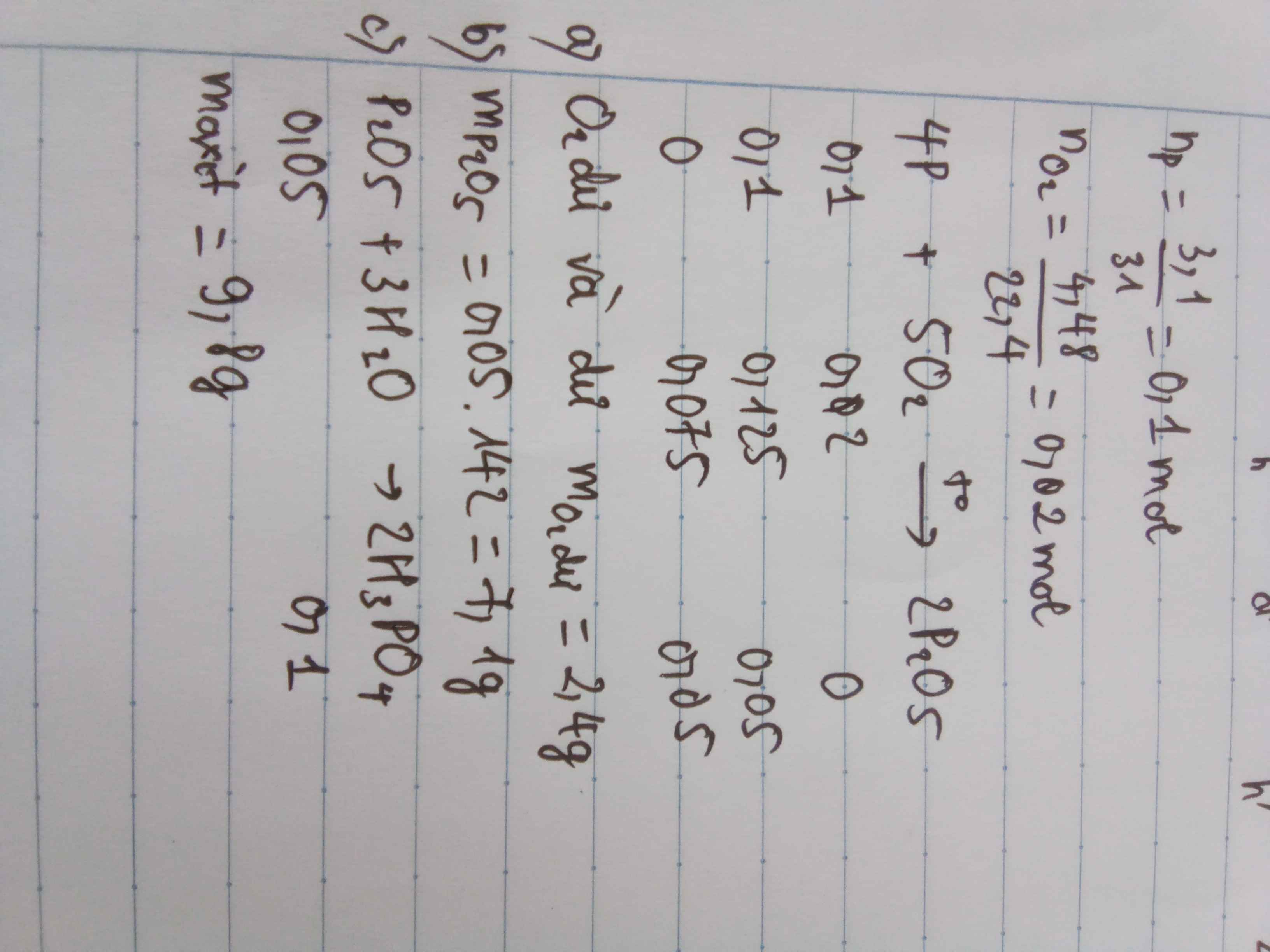
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{78,4}{98}=0,8\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Xét: \(\dfrac{0,2}{2}< \dfrac{0,8}{3}\) ( mol )
0,2 0,3 ( mol )
--> H2SO4 dư
\(m_{H_2SO_4\left(dư\right)}=\left(0,8-0,3\right).98=49\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{H_2SO_4}=\dfrac{78,4}{98}=0,8\left(mol\right)\\ pthh:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(LTL:\dfrac{0,2}{2}< \dfrac{0,8}{3}\)
=> H2SO4dư
\(n_{H_2SO_4\left(p\text{ư}\right)}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\\ m_{H_2SO_4\left(d\right)}=\left(0,8-0,3\right).98=49\left(g\right)\)