Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2 = 3.36/22.4 = 0.15 (mol)
M + H2SO4 => MSO4 + H2
0.15________________0.15
MM = 3.6/0.15 = 24
M là : Mg
PT: \(M+H_2SO_4\rightarrow MSO_4+H_2\)
Ta có: \(n_{H_2}=0,15\left(mol\right)\)
Theo PT: \(n_M=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{3,6}{0,15}=24\left(g/mol\right)\)
Vậy: M là Mg.
Bạn tham khảo nhé!

\(n_{H_2}=\dfrac{50.4}{22.4}=2.25\left(mol\right)\)
\(2M+2nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
\(\dfrac{4.5}{n}.............................2.25\)
\(M_M=\dfrac{54}{\dfrac{4.5}{n}}=12n\)
\(BL:n=2\Rightarrow M=24\)
\(M:Mg\)
\(n_{H_2SO_4}=n_{H_2}=2.25\left(g\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{2.25\cdot98\cdot100}{10}=2205\left(g\right)\)
Giả sử kim loại cần tìm là A có hóa trị n không đổi.
Ta có: \(n_{H_2}=\dfrac{50,4}{22,4}=2,25\left(mol\right)\)
BT e, có: \(n_A=\dfrac{2,25.2}{n}=\dfrac{4,5}{n}\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{54}{\dfrac{4,5}{n}}=12n\)
Với n = 1 ⇒ MA = 12 (loại)
Với n = 2 ⇒ MA = 24 (nhận)
Vậy: A là Magie (Mg).
BTNT H có: \(n_{H_2SO_4}=n_{H_2}=2,25\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=2,25.98=220,5\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{220,5.100}{10}=2205\left(g\right)\)
Bạn tham khảo nhé!

Đáp án A
Oxit chưa biết của kim loại nào → Gọi MxOy
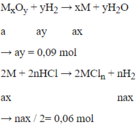
Mà : 56ax + 16ay = 4,8
→ ax = 0,06
→ x : y = ax : ay = 0,06 : 0,09 = 2 : 3 => M2O3
→ n = 0,12 : 0,06 = 2 => M hóa trị II
→ Chỉ có Fe thỏa mãn vì nó có hai hóa trị
Lưu ý: Bài toán này dễ nhầm lẫn nếu không để ý sự thay đổi hóa trị ở 2 phương trình.
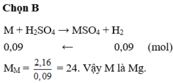
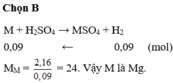
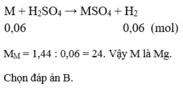

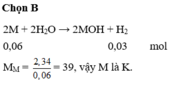
nH2 = 3.36/22.4 = 0.15 (mol)
M + H2SO4 => MSO4 + H2
0.15________________0.15
MM = 3.6/0.15 = 24
M là : Mg
Bảo toàn electron :
\(2n_M = 2n_{H_2}\\ \Rightarrow n_M = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow M = \dfrac{3,6}{0,15} = 24(Magie)\)
Vậy Kim loại M là Magie