Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Mục đích: Nhận biết ion Cl− trong dung dịch.
b) Acid hóa dung dịch sau khi thuỷ phân bằng dung dịch HNO3 để trung hòa NaOH dư.
Không thể thay dung dịch HNO3 bằng dung dịch H2SO4 hay HCI được vì khi cho dung dịch AgNO3 vào Ag+ sẽ kết hợp với SO42− và Cl− tạo kết tủa.

Đáp án B
nH+ ban đầu = 0,1.2.0,1 + 0,2.0,1 + 0,3.0,1 = 0,07
dung dịch C có pH=1 ⇒ nH+/C = 0,1.(0,3 + V)
⇒ nH+ ban đầu = nH+/C + nOH- ⇒ 0,07 = 0,1.(0,3 + V) + 0,2V +0,1.2V
⇒ V =0,08l

Chọn D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ n H + = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.
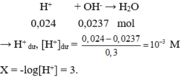

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)

Câu 1: nOH-=0,01V(mol) nH+ =0,03V(mol)
nOH-<nH+ nên axit dư -->nH+dư =0,02V(mol)--->CM H+=0,01(M)=10-2->pH=2
Chú thích do thể tích như nhau nên ko cần đổi
Câu 2:nOH-=0,03a(mol) nH+=0,01a(mol)-->OH-dư
noh-dư=0,02a(mol) mà v=2a-->Cm oh-=0,01=10-2(M)->pH=12
Câu 3:nOH-=0,03 nH+=0,035->H+dư nH+dư=0,005 mol
V=0,5(l) CmH+=10^-2 pH=2

\(1.n_{cation}=0,1.0,6+0,05.0,4=0,08\left(mol\right)\\ C_{M\left(cation\right)}=\dfrac{0,08}{0,6+0,4}=0,08\left(M\right)\\ 2.n_{cation}=0,2.0,2+2.0,3.0,1=0,1mol\\ C_{M\left(cation\right)}=\dfrac{0,1}{0,2+0,3}=0,2\left(M\right)\)
Cation của H2SO4 là H+.
Đề yêu cầu tính tổng nồng độ, không phải tổng số mol.

Tham khảo:
- Acid hóa dung dịch sau khi thuỷ phân bằng dung dịch HNO3 để tránh trường hợp dư base, sinh ra kết tủa Ag2O:
AgNO3 + NaOH → AgOH + NaNO3
2AgOH → Ag2O + H2O
- Không thể thay dung dịch HNO3 bằng dung dịch H2SO4 hay HCl vì AgNO3 có thể phản ứng với H2SO4 hay HCl tạo kết tủa Ag2SO4 hay AgCl làm sai kết quả thí nghiệm.
AgNO3 + HCl → AgCl↓ + HNO3
2AgNO3 + H2SO4 → Ag2SO4↓+ 2HNO3