Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


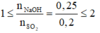 ⇒ phản ứng tạo 2 muối
⇒ phản ứng tạo 2 muối
Phương trình hóa học của phản ứng
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Gọi nNa2SO3 = x mol; nNaHSO3 = y mol
nNaOH = 2x + y = 0,25.
nSO2 = x + y = 0,2.
Giải ra ta có: x = 0,05, y = 0,15.
mNaHSO3 = 0,15 x 104 = 15,6g.
mNa2SO3 = 0,05 x 126 = 6,3g.

a)NaOH+SO2 \(\rightarrow\) NaHSO3 (1)
NaOH+SO2 \(\rightarrow\) Na2SO3+H2O (2)
b)Ta có co số mol SO2 là : n = 12,8 / 64 = 0,2
số mol NAOH là : n =0,25 x 1 = 0,25
Ta có tỷ lệ :
n [NaOH]/ n [SO2] = 0,25/0,2 = 1,25
Nên sẽ xảy ra đồng thời 2 phản ứng 1 và 2
NaOH + SO2 = NaHSO3 (1)
x mol x mol x mol
2NaOH + SO2 = Na2So3 + H2O (2)
y mol y/2 mol y/2 mol
Từ (1)(2): Ta có hệ phương trình :
x+y = 0,25
x+y/2 = 0,2
Giải hệ trên ta có x = 0,15 mol
y= 0,1 mol
Khối lượng muối sau phản ứng sẽ bao gồm 2 muối là NaHSO3 và NA2SO3
Số mol Nahso3 = x = 0,15 mol
==> Khối lương NAHSO3 = 0,15 x 104 = 15,6 g
Số mol NA2SO3 = y/2 = 0,1 /2 = 0,05 mol
==> Khối lượng NA2SO3 = 0,05 x 126 = 6,3 g
Vậy khối lượng muối thu dc sau phản ứng là : 15,6 + 6,3 = 21,9 g

Câu 2.Hấp thụ hoàn toàn 12,8 gam SO2 vào 250 ml dung dịch NaOH 1M.
a) Viết các phương trình hóa học của phản ứng xảy ra. b) Tính khối lượng muối tạo thành sau phản ứng.
----
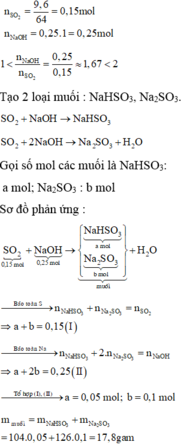
a) nSO2= 12,8/64= 0,2(mol)
nNaOH= 0,25.1=0,25(mol)
Ta có tỉ lệ: 1< nNaOH/nSO2= 0,25/0,2=1,25 <2
=> Tạo 2 muối: Na2CO3 và NaHCO3
Gọi x, y lần lượt là số mol NaOH (1) và NaOH (2)
PTHH: 2 NaOH + CO2 -> Na2CO3 + H2O (1)
x______________0,5x___0,5x(mol)
NaOH+CO2 -> NaHCO3 (2)
y______y_____y(mol)
=> \(\left\{{}\begin{matrix}x+y=0,25\\0,5x+y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,15\end{matrix}\right.\)
b) =>mNa2CO3=0,5.106x=0,5.106.0,1= 5,3(g)
mNaHCO3=0,15.84= 12,3(g)
-> m(muối)= mNa2CO3+ mNaHCO3= 5,3+12,3= 17,6(g)

nSO2=0,1(mol)
nKOH=0,1(mol)
nKOH/nSO2=1/1
=> P.ứ tạo duy nhất muối axit
a) PTHH: SO2 + KOH -> KHSO3
b) nKHSO3=nKOH=0,1(mol)
=>mKHSO3= 120.0,1=12(g)
Chúc em học tốt!
Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\n_{KOH}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\)Tạo muối axit
PTHH: \(SO_2+KOH\rightarrow KHSO_3\)
Theo PTHH: \(n_{KHSO_3}=0,1\left(mol\right)\) \(\Rightarrow m_{KHSO_3}=0,1\cdot136=13,6\left(g\right)\)

a) PTPỨ: \(SO_2+NaOH\rightarrow NaHSO_3\)
\(SO_2+2NaOH\rightarrow Na_2SO_3+H_2O\)
b) \(n_{SO_2}=0,2\left(mol\right);n_{NaOH}=1.0,25=0,25\left(mol\right)\)
\(\Rightarrow\frac{n_{NaOH}}{n_{SO_2}}=\frac{0,25}{0,2}=1,25\)
\(SO_2+NaOH\rightarrow NaHSO_3\)
a a a
\(SO_2+2NaOH\rightarrow Na_2SO_3+H_2O\)
b 2b b
\(\Rightarrow\left\{{}\begin{matrix}a+b=0,2\\a+2b=0,25\end{matrix}\right.\)
Giải ra ta được: \(a=0,15mol;b=0,05mol\)
\(\rightarrow m_{Na_2SO_3}=0,05\left(23,2+32+48\right)=6,3\left(g\right)\)
\(\rightarrow m_{NaHSO_3}=0,15\left(23+1+32+48\right)=15,6\left(g\right)\)
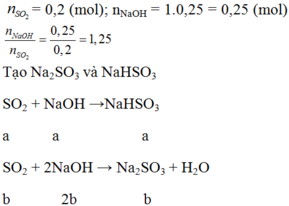
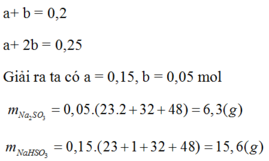

nSO2 = 12,8 / 64 = 0,2 mol.
nNaOH = 1 x250 / 1000 = 0,25 mol.
a) Phương trình hóa học của phản ứng
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Gọi nNa2SO3 = x; nNaHSO3 = y.
nNaOH = 2y + x = 0,25.
nSO2 = x + y = 0,2.
Giải ra ta có: x = 0,15, y = 0,05.
mNaHSO3 = 0,15 x 104 = 15,6g.
mNa2SO3 = 0,5 x 126 = 63g.