
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 2 :
a)
C% = S/(S + 100) . 100% = 204/(204 + 100) .100% = 67,12%
b) m NaCl = mdd . C% = 400.0,9% = 3,6(gam)
c)
Trích mẫu thử
Cho quỳ tím vào các mẫu thử
- mẫu thử hóa đỏ là HCl
- mẫu thử hóa xanh là NaOH
- mẫu thử không đổi màu là NaCl
Baì 3 :
n Fe = 60,5.46,289%/56 = 0,5(mol)
=> n Zn = (60,5 - 0,5.56)/65 = 0,5(mol)
Zn + 2HCl → ZnCl2 + H2
0,5...................0,5...............(mol)
Fe + 2HCl → FeCl2 + H2
0,5....................0,5..............(mol)
%m ZnCl2 = 0,5.136/(0,5.136 + 0,5.127) .100% = 51,71%
%m FeCl2 = 100% -51,71% = 48,29%

-Thí nghiệm: Cho một ít KMnO4 hoặc KClO3 vào ống nghiệm có cắm ống dẫn khí,đầu ống nghiệm được nút lại.
Câu hỏi là: cách điều chế oxi trong phòng thí nghiệm á
Giúp mình đi mọi ngừi ơiii 😥🥺

\(n_{Ca\left(OH\right)_2}=\dfrac{7,4}{74}=0,1\left(mol\right)\)
PTHH: CaO + H2O --> Ca(OH)2
0,1<--------------0,1
=> mCaO = 0,1.56 = 5,6 (g)

\(n_{Mg}=\dfrac{4,8}{24}=0,2mol\)
a)\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{MgCl_2}=0,2\cdot95=19g\)
b)\(V_{H_2}=0,2\cdot22,4=4,48l\)
c)\(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
Sau phản ứng Mg còn dư và dư 0,15mol
\(m_{Mgdư}=0,15\cdot24=3,6g\)

Bài 3 :
\(n_{Zn}=\dfrac{16.25}{65}=0.25\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.25....0.5........0.25........0.25\)
\(m_{HCl}=0.5\cdot36.5=18.25\left(g\right)\)
\(V_{H_2}=0.25\cdot22.4=5.6\left(l\right)\)
\(m_{ZnCl_2}=0.25\cdot136=34\left(g\right)\)

Câu 6.
\(n_P=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{33,6}{32}=1,05mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
\(\dfrac{0,4}{4}\)< \(\dfrac{1,05}{5}\) ( mol )
0,4 0,5 0,2 ( mol )
Chất dư là O2
\(m_{O_2\left(dư\right)}=\left(1,05-0,5\right).32=17,6g\)
\(m_{P_2O_5}=0,2.142=28,4g\)
Câu 7.\(1m^3=1000l\)
\(n_{CH_4}=\dfrac{1000}{22,4}.98\%=43,75mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
43,75 87,5 ( mol )
\(V_{O_2}=87,5.22,4=1960l\)
Câu 8.
Gọi kim loại đó là R
\(4R+3O_2\rightarrow\left(t^o\right)2R_2O_3\)
\(n_{R_2O_3}=\dfrac{10,2}{2M_R+48}\)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(4R+3O_2\rightarrow\left(t^o\right)2R_2O_3\)
\(\dfrac{30,6}{4M_R+96}\) <-- \(\dfrac{10,2}{2M_R+48}\) ( mol )
Ta có:
\(\dfrac{30,6}{4M_R+96}=0,15\)
\(\Leftrightarrow0,6M_R+14,4=30,6\)
\(\Leftrightarrow M_R=27\) ( g/mol )
=> R là Nhôm (Al)



 Giúp mk ik mn
Giúp mk ik mn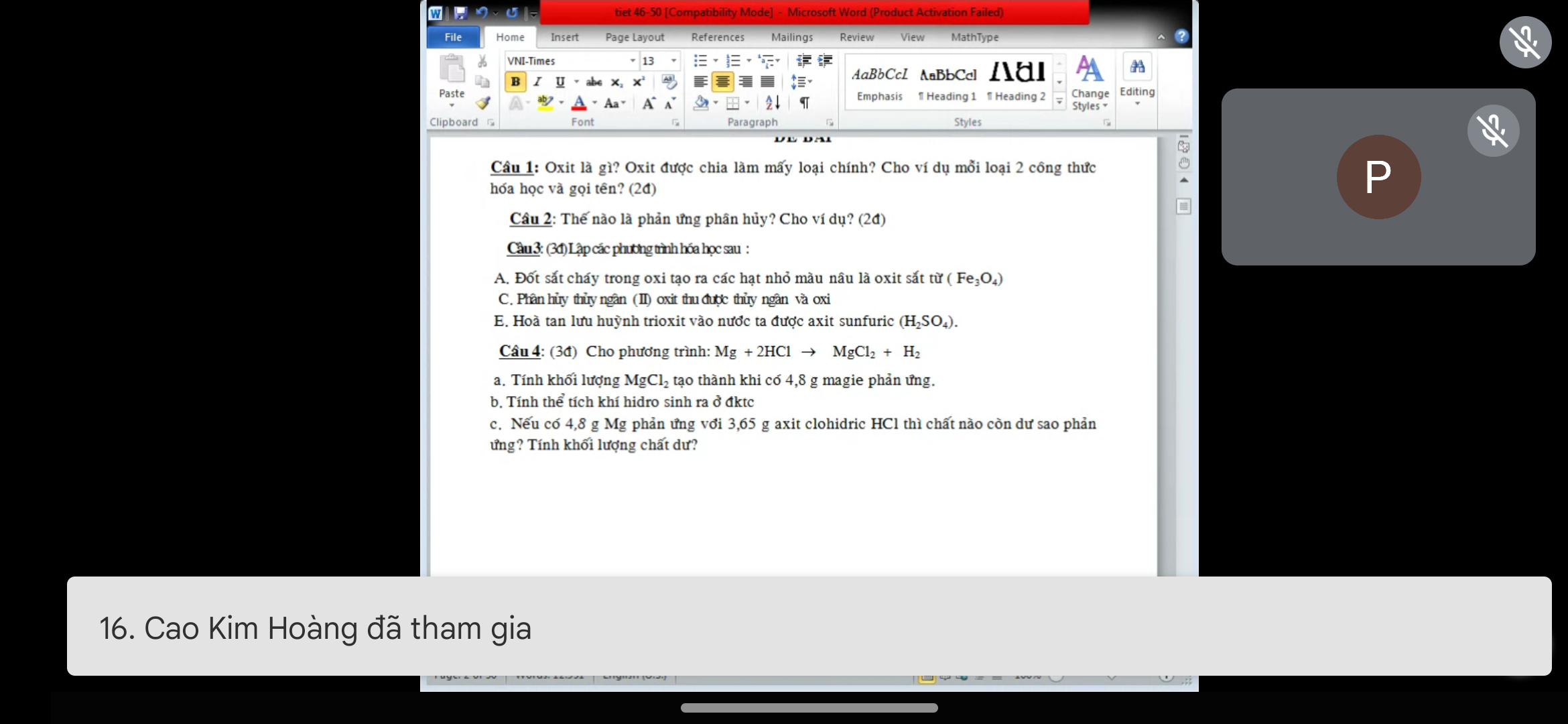


Câu 4 :
1,$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
2,$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
3,$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
4,$2Na + 2H_2O \to 2NaOH + H_2$
b) phản ứng thế : 2,4
Phản ứng hóa hợp : 1
Phản ứng phân hủy : 3
Câu 5 :
-Oxit :
CuO : Đồng II oxit
P2O5 : điphotpho pentaoxit
- Axit :
H2SO3 : Axit sunfuro
HCl : Axit clohidric
- Bazo :
Cu(OH)2 : Đồng II hidroxit
NaOH : Natri hidroxit
- Muối :
K2SO4 : Kali sunfat
Fe(NO3)3 : Sắt III nitrat
Câu 6 :
a)
\(n_{Mg} = n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ \Rightarrow a = 0,3.24 = 7,2(gam)\\ b) n_{HCl} = 2n_{H_2} = 0,6(mol)\\ \Rightarrow m_{dd\ HCl} = \dfrac{0,6.36,5}{7,3\%} = 300(gam)\)
Câu 7 :
\(a) \text{Gọi kim loại cần tìm là R}\\ 4R + 3O_2 \xrightarrow{t^o} 2R_2O_3\\ V_{O_2} = 33,6.20% = 6,72(lít)\\ n_{O_2} =\dfrac{6,72}{22,4} = 0,3(mol)\\ n_R = \dfrac{4}{3}n_{O_2} =0,4(mol)\\ \Rightarrow M_R = \dfrac{10,8}{0,4} = 27(Al)\\ b) m_{O_2} = 0,3.32 = 9,6(gam)\)