
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


A. MgSO4
- Liên kết ion được hình thành bởi cation kim loại Mg2+ và anion gốc axit SO42-
- Liên kết cộng hóa trị giữa S và O.
A: MgSO4
Liên kết ion giữa Mg2+ và SO42-, liên kết cộng hóa trị giữa S và O

nS = \(\dfrac{3,2}{32}=0,1\left(mol\right)\)
PTHH: 2Al + 3S \(\underrightarrow{t^o}\) Al2S3
0,1 \(\dfrac{1}{30}\)
Al2S3 + 6HCl ---> 2AlCl3 + 3H2S
\(\dfrac{1}{30}\) 0,1
H2S + Pb(NO3)2 ---> PbS + 2HNO3
0,1 0,1
m = mPbS = 0,1 . 239 = 23,9 (g)

nHCl = \(\dfrac{91,25.20\%}{36,5}=0,5\left(mol\right)\)
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Fe_2O_3}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a 2a a a
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O
b 6b 2b 3b
Hệ phương trình: \(\left\{{}\begin{matrix}56a+160b=13,6\\2a+6b=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,1.56=5,6\left(g\right)\\m_{Fe_2O_3}=0,05.160=8\left(g\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{13,6}=41,17\%\\\%m_{Fe_2O_3}=100\%-41,17\%=58,83\%\end{matrix}\right.\)
mH2 = 0,1 . 2 = 0,2 (g)
=> \(m_{dd}=91,25+13,6-0,2=104,65\left(g\right)\)
nFeCl3 = 0,1 + 0,05.2 = 0,2 (mol)
=> mFeCl3 = 0,2.162,5 = 32,5 (g)
=> \(C\%_{FeCl_3}=\dfrac{32,5}{104,65}=31,05\%\)
PTHH:
Fe + 2H2SO4 ---> Fe2(SO4)3 + SO2 + 2H2O
0,1 0,1
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O
mddNaOH = 64.1,025 = 65,6 (g)
=> nNaOH = \(\dfrac{65,6.10\%}{40}=0,164\left(mol\right)\)
T = \(\dfrac{0,164}{0,1}=1,64\) => phản ứng tạo cả 2 muối
Gọi \(\left\{{}\begin{matrix}n_{NaOH\left(tạo.muối.axit\right)}=x\left(mol\right)\\n_{NaOH\left(tao.nuôi.trung.hoà\right)}=y\left(mol\right)\end{matrix}\right.\)
PTHH:
NaOH + SO2 ---> NaHSO3
x x x
2NaOH + SO2 ---> Na2SO3 + H2O
y \(\dfrac{y}{2}\) y
Hệ phương trình: \(\left\{{}\begin{matrix}x+y=0,164\\x+\dfrac{y}{2}=0,1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,036\left(mol\right)\\y=0,128\left(mol\right)\end{matrix}\right.\)
Đổi 64ml = 0,064l
\(\Rightarrow\left\{{}\begin{matrix}C_{MNaHCO_3}=\dfrac{0,036}{0,064}=0,5625M\\C_{MNa_2CO_3}=\dfrac{0,128}{0,064}=2M\end{matrix}\right.\)
Em làm nhầm, nNa2SO3 = y/2 = 0,128/22 = 0,064 (mol)
=> CMNa2SO3 = 00,064/0,064 = 1M

\(n_{Ba\left(OH\right)_2}=\dfrac{855.10\%}{171}=0,5\left(mol\right)\)
\(m_{dd.NaOH}=1,28.125=160\left(g\right)\)
=> \(n_{NaOH}=\dfrac{160.25\%}{40}=1\left(mol\right)\)
Gọi số mol H2SO4 là a (mol)
PTHH: Ba(OH)2 + H2SO4 --> BaSO4 + 2H2O
0,5------>0,5
2NaOH + H2SO4 --> Na2SO4 + 2H2O
1----->0,5
=> nH2SO4 = 0,5 + 0,5 = 1 (mol)
=> \(C\%_{dd.H_2SO_4}=\dfrac{1.98}{200}.100\%=49\%\)

a) Cl2 + 2NaOH --> NaClO + NaCl + H2O
Chất oxh: Cl2, chất khử: Cl2
| Sự oxh | Cl0 -1e--> Cl+1 | x1 |
| Sự khử | Cl0 +1e--> Cl-1 | x1 |
b) \(n_{Cl_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right);n_{NaOH}=0,5.4=2\left(mol\right)\)
PTHH: Cl2 + 2NaOH --> NaClO + NaCl + H2O
_____0,8---->1,6--------->0,8---->0,8
=> \(\left\{{}\begin{matrix}C_{M\left(NaCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(NaClO\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(NaOH\right)}=\dfrac{2-1,6}{0,5}=0,8M\end{matrix}\right.\)

a)
Gọi số mol Fe, Fe2O3 là a, b (mol)
=> 56a + 160b = 48,8 (1)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
a-------------------->0,5a------>1,5a
Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
b----------------------->b
=> \(0,5a+b=\dfrac{140}{400}=0,35\) (2)
(1)(2) => a = 0,3 (mol); b = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,3.56}{48,8}.100\%=34,426\%\\\%m_{Fe_2O_3}=\dfrac{0,2.160}{48,8}.100\%=65,574\%\end{matrix}\right.\)
b) nSO2 = 1,5a = 0,45 (mol)
nNaOH = 1.0,45 (mol)
Xét tỉ lệ: \(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0,45}{0,45}=1\) => Tạo muối NaHSO3
PTHH: NaOH + SO2 --> NaHSO3
0,45-------------->0,45
=> \(C_{M\left(dd.NaHSO_3\right)}=\dfrac{0,45}{0,45}=1M\)

nH2SO4=0,045mol nKOH=0,03
PT: X + H2SO4 ==> XSO4 + H2 (1)
H2SO4 + 2KOH ==> K2SO4 + 2H2O (2)
Từ 1 --> nH2SO4 dư = 0,015
--> nX=nH2SO4 pứ= 0,045-0,015=0,03
MX=1,2:0,03=40 --> X là Ca

a)
Fe không phản ứng với H2SO4 đặc nguội
\(n_{SO_2}=\dfrac{1,176}{22,4}=0,0525\left(mol\right)\)
PTHH: Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,0525<-0,105<----0,0525<-0,0525
\(\%m_{Cu}=\dfrac{0,0525.64}{27}.100\%=12,44\%\)
\(\%m_{Fe}=100\%-12,44\%=87,56\%\)
b) \(C_{M\left(dd.H_2SO_4\right)}=\dfrac{0,105}{0,8}=0,13125M\)
c) nNaOH = 1,25.0,5 = 0,625 (mol)
PTHH: 2NaOH + CuSO4 --> Cu(OH)2 + Na2SO4
Xét tỉ lệ: \(\dfrac{0,625}{2}>\dfrac{0,0525}{1}\) => NaOH dư, CuSO4 hết
PTHH: 2NaOH + CuSO4 --> Cu(OH)2 + Na2SO4
0,105<---0,0525------------------>0,0525
=> \(\left\{{}\begin{matrix}C_{M\left(NaOH_{dư}\right)}=\dfrac{0,625-0,105}{0,5}=1,04M\\C_{M\left(Na_2SO_4\right)}=\dfrac{0,0525}{0,5}=0,105M\end{matrix}\right.\)
a, nH2 = \(\dfrac{\dfrac{1176}{1000}}{22,4}=0,0525\left(mol\right)\)
PTHH: Cu + 2H2SO4(đặc, nguội) ---> CuSO4 + SO2 + 2H2O
0,0525 0,105 0,0525 0,0525
=> \(\left\{{}\begin{matrix}m_{Cu}=0,0525.64=3,36\left(g\right)\\m_{Fe}=27-3,36=23,64\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{3,36}{27}=12,44\%\\\%m_{Fe}=100\%-12,44\%=87,56\%\end{matrix}\right.\)
b, \(C_{MddH_2SO_4}=\dfrac{0,105}{\dfrac{800}{1000}}0,13125M\)
c, nNaOH = 1,25.\(\dfrac{500}{1000}\) = 0,625 (mol)
PTHH: CuSO4 + 2NaOH ---> Cu(OH)2 + Na2SO4
LTL: 0,0525 < \(\dfrac{0,625}{2}\) => NaOH dư
Theo pthh: \(\left\{{}\begin{matrix}n_{NaOH\left(pư\right)}=2n_{CuSO_4}=2.0,0525=0,105\left(mol\right)\\n_{Cu\left(OH\right)_2}=n_{Na_2SO_4}=n_{CuSO_4}=0,0525\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{MNaOH\left(dư\right)}=\dfrac{0,625-0,105}{0,5}=1,04M\\C_{MNa_2SO_4}=\dfrac{0,0525}{0,5}=0,105M\end{matrix}\right.\)

1. Ta cân bằng 2 phương trình nhỏ:
8Al + 30HNO3 →8Al(NO3)3 + 3N2O + 15H2O (1)
Al +4 HNO3 →Al(NO3)3 + NO + 2H2O (2)
Do tỉ lệ thể tích N2O : NO = 1:3. Mà hệ số của N2O ở (1) là 3 do đó ta nhân cả 2 vế của (2) với 9 rồi cộng với (1)
8Al + 30HNO3 →8Al(NO3)3 + 3N2O + 15H2O (1)
9x (Al + 4 HNO3 →Al(NO3)3 + NO + 2H2O) (2)
Cộng lại được:
17Al + 66HNO3 →17Al(NO3)3 + 3N2O + 9NO + 33H2O
4.
29x | Al→Al3++3e
3x | 7N+5+ 29e→3N+2 + 2N2
Cân bằng: 29Al + 108HNO3 → 29Al(NO3)3+9NO+6N2+ 54H2O

1
a
Tổng số proton trong \(R_2O\) là 22, ta có:
\(2p_R+p_O=22\\ \Leftrightarrow2p_R+8=22\\ \Rightarrow p_R=\dfrac{22-8}{2}=7\)
=> R là N (Nito)
Xác định vị trí của R (N) trong bản tuần hoàn: thuộc nhóm VA, chu kỳ 2
b
\(\%_{R\left(R_2O\right)}=\%_{N\left(N_2O\right)}=\dfrac{14.2}{14.2+16}.100\%=63,64\%\)
2
Trong phân tử \(AB_2\) có tổng số hạt mang điện bằng 44, ta có:
\(2p_A+4p_B=44\left(1\right)\)
Số hạt mang điện của nguyên tử B nhiều hơn số hạt mang điện của nguyên tử A là 4, ta có:
\(2p_B-2p_A=4\Leftrightarrow-2p_A+2p_B=4\left(2\right)\)
Từ (1), (2) giải được \(\left\{{}\begin{matrix}p_A=6\\p_B=8\end{matrix}\right.\)
=> Nguyên tố A là cacbon và B là oxi.
a
Do cacbon có số hiệu nguyên tử là 6 => nguyên tử C có 6 electron.
=> Số electron phân lớp ngoài của nguyên tử nguyên tố A là 4.
b
Nguyên tử nguyên tố B (O) là phi kim. Vì nguyên tử O có 6 e lớp ngoài cùng.

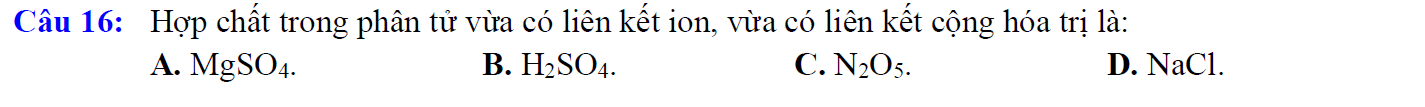 Giúp mình với ạ, mình đang cần gấp ạ
Giúp mình với ạ, mình đang cần gấp ạ

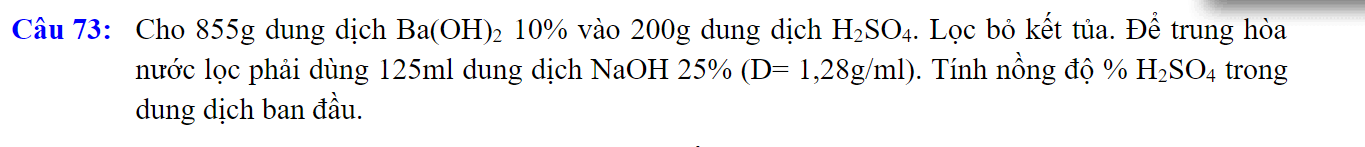
 Giúp mình câu này với ạ, mình đang cần gấp ạ
Giúp mình câu này với ạ, mình đang cần gấp ạ




mạng có ấy
có tớ đã tra