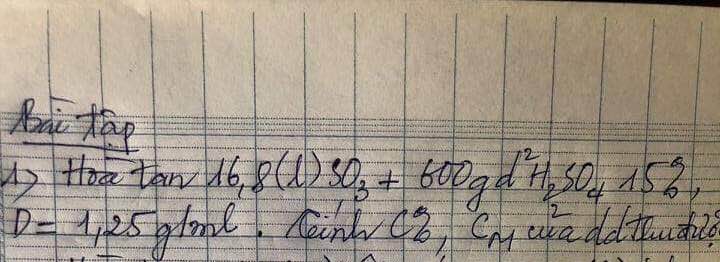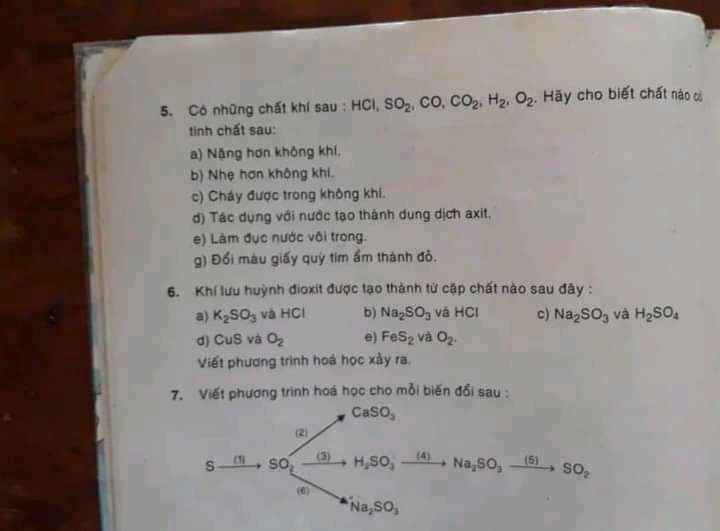Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 7 :
Pt : ZnO + 2HCl → ZnCl2 + H2O\(|\)
1 2 1 1
a 2a
Fe2O3 + 6HCl → 2FeCl3 + 3H2O\(\)\(|\)
1 6 2 3
b 6b
Gọi a là số mol của ZnO
b là số mol của Fe2O3
Theo đề ta có : mZnO + mFe2O3 = 28,15 (g)
⇒ nZnO . MZnO + nFe2O3 . MFe2O3 = 28,15 g
⇒ 81a + 160b = 28,15 g (1)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{6.547,5}{100}=32,85\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{32,85}{36,5}=0,9\left(mol\right)\)
⇒ 2a + 6b = 0,9 (2)
Từ (1),(2) , ta có hệ phương trình :
81a + 160b = 28,15
2a + 6b = 0,9
⇒ \(\left\{{}\begin{matrix}a=0,15\\b=0,1\end{matrix}\right.\)
Khối lượng của kẽm oxit
mZnO = nZnO . MZnO
= 0,15 . 81
= 12,15 (g)
Khối lượng của sắt (III) oxit
mFe2O3 = nFe2O3 . MFe2O3
= 0,1 . 160
= 16 (g)
0/0ZnO = \(\dfrac{m_{ZnO}.100}{m_{hh}}=\dfrac{12,15.100}{28,15}=43,16\)0/0
0/0Fe2O3 = \(\dfrac{m_{Fe2O3}.100}{m_{hh}}=\dfrac{16.100}{28,15}=56,84\)0/0
Chúc bạn học tốt


Bài 2 :
$n_{Ba(OH)_2} = 0,3(mol) ; n_{BaSO_3} = 0,08(mol)$
TH1 : $Ba(OH)_2$ dư
$Ba(OH)_2 + SO_2 \to BaSO_3 + H_2O$
$n_{SO_2} = n_{BaSO_3} = 0,08(mol)$
$V_{SO_2} = 0,08.22,4 = 1,792(lít)$
TH2 : có tạo muối axit
SO2 + Ba(OH)2 → BaSO3 + H2O
0,08......0,08..............0,08..............(mol)
2SO2 + Ba(OH)2 → Ba(HSO3)2
0,44........0,22......................................(mol)
$V_{SO_2} = (0,08 + 0,44).22,4 = 11,648(lít)$
Bài 4 :
$n_{BaCO_3} = 0,05(mol)$
CO2 + Ba(OH)2 → BaCO3 + H2O
0,05......0,05..............0,05..............(mol)
2CO2 + Ba(OH)2 → Ba(HCO3)2
..............0,2..................0,2....................(mol)
Ba(HCO3)2 \(\xrightarrow{t^o}\)BaCO3 + CO2 + H2O
0,2.....................0,2........................(mol)
m = 0,2.197 = 39,4 gam

Bài 1:
(1) \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
(2) \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
(3) \(AlCl_3+3KOH\rightarrow3KCl+Al\left(OH\right)_3\downarrow\)
(4) \(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
(5) \(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\)
(6) \(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
(7) \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\)
(8) \(Al+NaOH+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\uparrow\)
(9) \(2Al_2O_3\xrightarrow[criolit]{đpnc}4Al+3O_2\)
Bài 2:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
a_______a_______a_____a (mol)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b_______b________b____b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+24b=21,6\\a+b=\dfrac{11,2}{22,4}=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,3\cdot56}{21,6}\cdot100\%\approx77,78\%\\\%m_{Mg}=22,22\%\end{matrix}\right.\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=n_{Mg}=0,2\left(mol\right)\\n_{Fe\left(OH\right)_2}=n_{Fe}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{kết.tủa}=m_{Fe\left(OH\right)_3}+m_{Mg\left(OH\right)_2}=0,3\cdot107+0,2\cdot56=43,3\left(g\right)\)
Theo các PTHH: \(n_{H_2SO_4\left(p/ứ\right)}=0,5\left(mol\right)\) \(\Rightarrow n_{H_2SO_4\left(ban.đầu\right)}=0,5\cdot120\%=0,6\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,6\cdot98}{10\%}=588\left(g\right)\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{chất.rắn}=m_{MgO}+m_{Fe_2O_3}=0,2\cdot40+0,15\cdot160=32\left(g\right)\)

nSO3=0,75(mol)
mH2SO4(bđ)= 600.15%=90(g) => nH2SO4(bđ)= 90/98=45/49(mol)
PTHH: SO3 + H2O -> H2SO4
0,75______0,75____0,75(mol)
=> mH2SO4(tổng)= 0,75.98+90= 163,5(g)
mddH2SO4= mSO3+mddH2SO4(bđ)= 0,75.80 + 600= 660(g)
=>C%ddH2SO4(sau)= (163,5/660).100=24,773%
VddH2SO4(sau)= 660/1,25= 528(ml)=0,528(l)
nH2SO4(tổng)= 45/49 + 0,75= 327/196(mol)
=> CMddH2SO4(sau)= 327/196 : 0,528=3,16(M)


Câu 6:
PTHH: \(K_2SO_3+2HCl\rightarrow2KCl+H_2O+SO_2\uparrow\)
\(Na_2SO_3+2HCl\rightarrow2NaCl+H_2O+SO_2\uparrow\)
\(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+SO_2+H_2O\)
\(CuS+\dfrac{3}{2}O_2\xrightarrow[]{t^o}CuO+SO_2\uparrow\)
\(4FeS_2+11O_2\xrightarrow[]{t^o}2Fe_2O_3+8SO_2\uparrow\)

10. \(n_{Na}=\dfrac{6,9}{23}=0,3\left(mol\right)\)
\(n_{Na_2O}=\dfrac{9,3}{62}=0,15\left(mol\right)\)
Na + H2O ------> NaOH + \(\dfrac{1}{2}H_2\)
Na2O + H2O ------> 2NaOH
Ta có : \(\Sigma n_{NaOH}=0,3+0,15.2=0,6\left(mol\right)\)
\(m_{ddNaOH\left(8\%\right)}=\dfrac{0,6.40}{8\%}=300\left(g\right)\)
Gọi x là khối lượng NaOH tinh khiết 80% phải thêm
=> \(m_{ddNaOH\left(80\%\right)}=\dfrac{x}{80\%}\)(g)
Theo đề bài ta có : \(\dfrac{24+x}{300+\dfrac{x}{80\%}}.100=15\)
=> x=25,85(g)

7. a) Hợp chất X của A với C: ACx
Ta có: \(\dfrac{A}{A+12x}.100=62,5\)
Lập bảng:
| x | 1 | 2 | 3 |
| A | 20 | 40 | 60 |
| Kết luận | Loại | Chọn (Ca) | Loại |
Vậy nguyên tố A là Ca
CTPT của hợp chất X : CaC2
CTCT:
b)Gọi số oxh của C trong chất là x. Ta có số oxh của Ca là +2
Trong CaC2: 2 + 2. x = 0 → x = -1
Số oxh của C trong CaC2 là -1