
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


bạn bấm máy tính hoặc giải hệ:
\(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}27x+56y=11\\84x+56y=22,4\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}57x=11,4\\27x+56y=11\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\27.0,2+56y=11\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)


\(S_{CuSO_4\left(t^o=10^oC\right)}=17,4\left(g\right)\) Đề cho sai rồi
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{H_2SO_4}=n_{CuSO_4}=0,2\left(mol\right)\)
\(m_{H_2SO_4}=0,2.98=19,6\left(g\right)\)
\(m_{dd\left(H_2SO_4\right)}=\dfrac{19,6}{20}.100=98\left(g\right)\)
\(m_{CuSO_4}=0,2.160=32\left(g\right)\)
Khối lượng dung dịch sau khi hòa tan CuO:
\(0,2.80+98=114\left(g\right)\)
Khối lượng nước có trong dung dịch:
\(114-32=82\left(g\right)\)
Gọi a là số mol CuSO4.5H2O tách ra
Khối lượng CuSO4 còn lại trong dung dịch là: 32- 160a
Khối lượng H2O còn lại trong dung dịch là: 82 – 90a
Vì độ tan của CuSO4 ở 100C là 17,4 gam nên ta có:
\(\dfrac{32-160a}{82-90a}=\dfrac{17,4}{100}\)
\(\Rightarrow a\simeq0,12285\left(mol\right)\)
Khối lượng tinh thể đã tách ra: \(0,12285.250=30,7125g\)

Giả sử X có hóa trị n không đổi.
PT: \(4X+nO_2\underrightarrow{t^o}2X_2O_n\)
Ta có: \(n_X=\dfrac{8,1}{M_X}\left(mol\right)\)
\(n_{X_2O_n}=\dfrac{15,3}{2M_X+16n}\left(mol\right)\)
Theo PT: \(n_X=2n_{X_2O_n}\Rightarrow\dfrac{8,1}{M_X}=\dfrac{2.15,3}{2M_X+16n}\Rightarrow M_X=9n\left(g/mol\right)\)
Với n = 3 thì MX = 27 (g/mol) là thỏa mãn.
Vậy: M là Nhôm.

C+O2=to=>CO2
1 1 1
a/
no2=\(\frac{v}{22.4}\)=\(\frac{4.48}{22.4}\)=0.2 mol
so sánh tỉ lệ:
\(\frac{n_C}{1}\)=\(\frac{0.3}{1}\)> \(\frac{n_{O2}}{1}\)=\(\frac{0.2}{1}\)
vậy C dư , oxi hết , ta tinh số mol các chất theo nO2
theo pthh ta có nO2=nCO2=0.2 mol
=>mCO2=n *M=0.2*44=8.8 g
b/
nC=\(\frac{m}{M}\)=\(\frac{6}{12}\)=0.5 mol
no2 =\(\frac{v}{22.4}\)=\(\frac{13.44}{22.4}\)=0.6 mol
so sánh tỉ lệ: \(\frac{n_C}{1}\)=\(\frac{0.5}{1}\) < \(\frac{n_{O2}}{1}\)=\(\frac{0.6}{1}\)
vậy oxi dư, cacbon hết ta tính số mol các chất theo nC
theo pthh ta có :nC=nCO2=0.5 mol
=> mCO2=n*M=0.5*44=22 g
a) PTHH: C + O2 -to-> CO2
Ta có:
\(n_{O_2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\frac{0,3}{1}>\frac{0,2}{1}\)
=> C dư, O2 hết nên tính theo \(n_{O_2}\)
Theo PTHH và đề bài, ta có:
\(n_{CO_2}=n_C=0,2\left(mol\right)\)
Khối lượng khí CO2 thu được sau phản ứng:
\(m_{CO_2}=0,2.44=8,8\left(g\right)\)

Oxit axit bao gồm: SO2, N2O5, CO2
Oxit bazo bao gồm: Fe2O3, CuO, CaO

| Thí nghiệm | Hiện tượng | Nhận xét-Dấu hiệu |
| 1 | Giấy cháy thành than | Có sự tạo thành chất mới. Dấu hiệu: Giấy chuyển từ màu trắng sang màu đen |
| 2 | Mẩu nến tan ra thành lỏng rồi thành hơi | Ko tạo thành chất mới |
| 3 | Xuất hiện 1 chất rắn màu trắng | Có sự tạo thành chất mới. Dấu hiệu: Xuất hiện 1 chất ko tan có màu trắng |
| 4 | - Ống 1: thuốc tím tan ra -Ống 2: Có chất rắn màu đen ko tan trong nước | -Ống 1: Ko tạo thành chất mới -Ống 2: Có tạo thành chất mới. Dấu hiệu: Xuất hiện sự thay đổi màu sắc tím sang đen, chất sau khi đun ko tan trong nước |
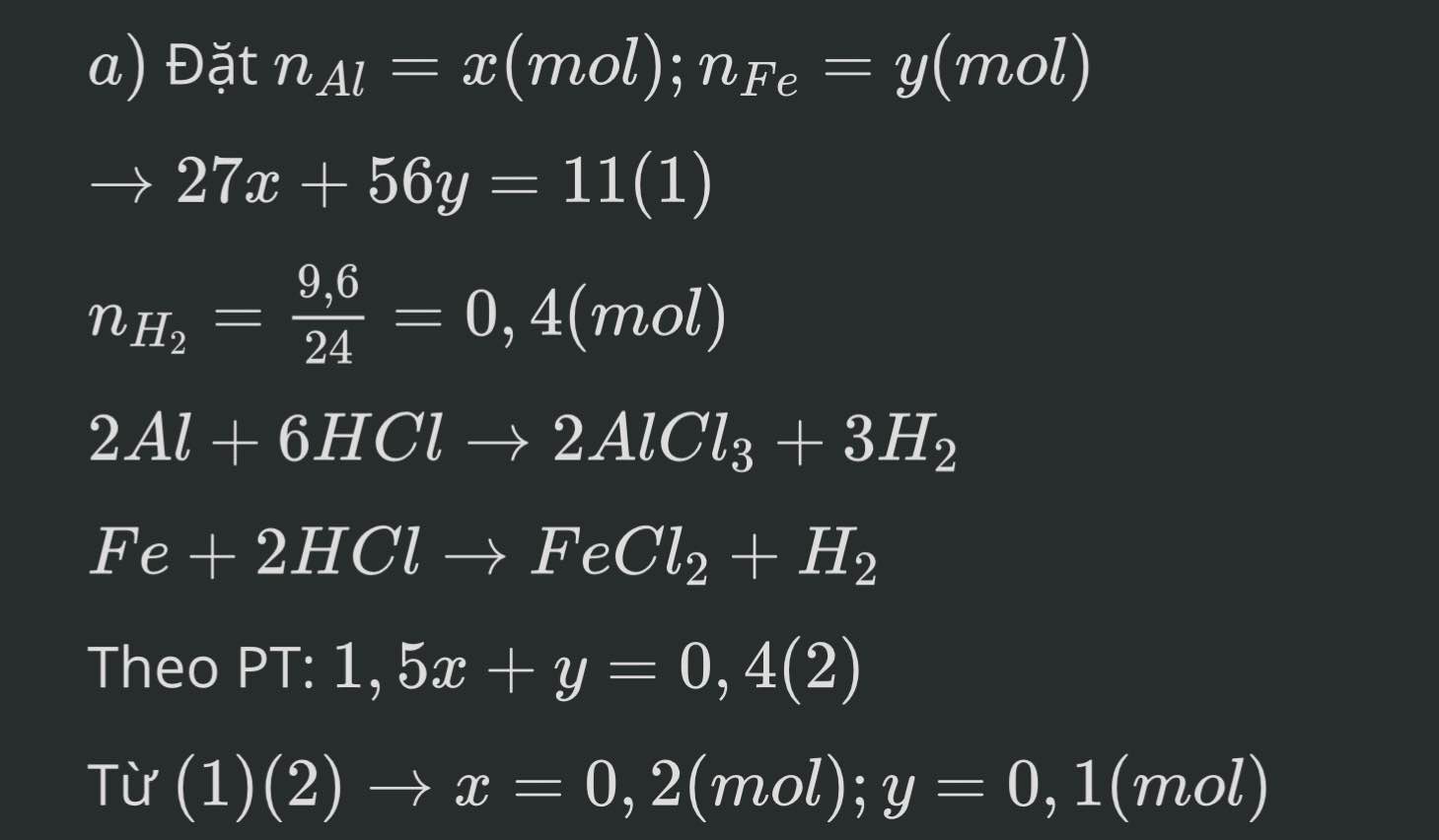
 m giải chi tiết ạ
m giải chi tiết ạ n giúp em với ạ giải chi tiết ạ
n giúp em với ạ giải chi tiết ạ


1 mol chứa 6,022.1023 nguyên tử/ phân tử.
⇒ 0,1 mol H chứa: 0,1.6,022.1023 = 0,6022.1023 (nguyên tử)
10 mol H2O chứa: 10.6,022.1023 = 60,22.1023 (phân tử)
0,24 mol Fe chứa: 0,24.6,022.1023 = 1,44528.1023 (nguyên tử)
0,15 mol CO2 chứa: 0,15.6,022.1023 = 0,9033.1023 (phân tử)
0,01 mol H2 chứa: 0,01.6,022.1023 = 0,06022.1023 (phân tử)
1,44 mol C chứa: 1,44.6,022.1023 = 8,67168.1023 (nguyên tử)
đề bài cho ai không có sách
hãy cho biết số nguyên tử hoặc phân tử có trong những lượng chất sau:
0,1 mol nguyên tử H
10 mol phân tử H\(_2\)O
0,24 MOL NGUYÊN TỬ Fe
0,15 mol phân tử CO\(_2\)
0,01 MOL PHÂN TỬ H\(_2\)
1,44 mol nguyên tử C