Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử X có hóa trị n không đổi.
PT: \(4X+nO_2\underrightarrow{t^o}2X_2O_n\)
Ta có: \(n_X=\dfrac{8,1}{M_X}\left(mol\right)\)
\(n_{X_2O_n}=\dfrac{15,3}{2M_X+16n}\left(mol\right)\)
Theo PT: \(n_X=2n_{X_2O_n}\Rightarrow\dfrac{8,1}{M_X}=\dfrac{2.15,3}{2M_X+16n}\Rightarrow M_X=9n\left(g/mol\right)\)
Với n = 3 thì MX = 27 (g/mol) là thỏa mãn.
Vậy: M là Nhôm.

"mọi người cho em hỏi là cái phần xét tỉ lệ để ra 2 muối dưới đây nó có nghĩa là gì, để làm gì thế"
=> Để tìm số muối tạo ra bn nhé :)
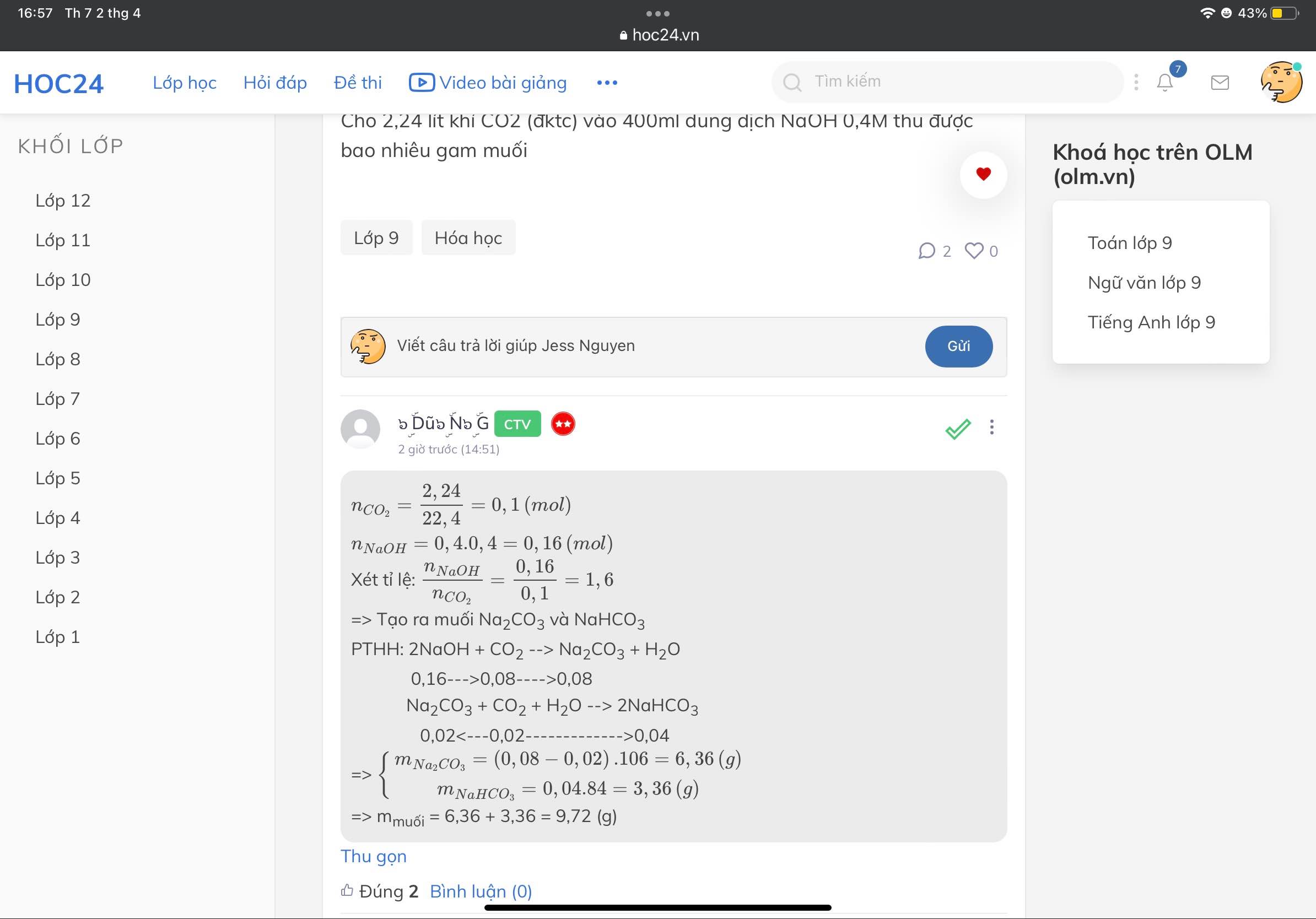
PTHH: NaOH + CO2 --> Na2CO3 + H2O (1)
NaOH + CO2 --> NaHCO3 (2)
Bn xét tỉ lệ \(T=\dfrac{n_{NaOH}}{n_{CO_2}}\)
Xảy ra 3 TH
+ Nếu T \(\le1\) => Ra NaHCO3 (Xảy ra pư (2) và tính số mol theo NaOH)
+ Nếu T \(\ge2\) => Ra Na2CO3 (Xảy ra pư (1) và tính số mol theo CO2)
+ Nếu 1 < T < 2 => Ra 2 muối Na2CO3, NaHCO3 (Xảy ra đồng thời (1), (2))
* Nếu nó tạo ra 2 muối thì bn có thể lm 2 cách
+ đặt ẩn, giải hệ phương trình (giống bn Kudo)
+ viết phương trình tạo muối trung hòa trước (tính số mol theo NaOH), sau đó CO2 tác dụng với muối trung hòa tạo ra muối axit (tính số mol theo CO2 còn lại)
PTHH: 2NaOH + CO2 --> Na2CO3 + H2O
Na2CO3 + CO2 + H2O --> 2NaHCO3
Còn nếu bn không thích dùng tỉ lệ thì bn cứ viết phương trình tạo muối trung hòa trước, sau đó CO2 tác dụng với muối trung hòa tạo ra muối axit thôi (đúng với mọi TH :D)

\(a.\)
\(m_{hh}=m_{SO_2}+m_{CO_2}=0.15\cdot64+0.2\cdot44=18.4\left(g\right)\)
\(n_{hh}=0.15+0.2=0.35\left(mol\right)\)
\(\overline{M}_X=\dfrac{m_{hh}}{n_{hh}}=\dfrac{18.4}{0.35}=52.5\left(\dfrac{g}{mol}\right)\)
\(b.\)
\(d_{X\text{/}NO_2}=\dfrac{52.57}{46}=1.14\)

a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right);n_{H_2SO_4}=0,1.0,5=0,05\left(mol\right)\)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Theo đề:0,2......0,05
Lập tỉ lệ: \(\dfrac{0,2}{2}>\dfrac{0,05}{3}\)=> Al dư, H2SO4 hết
=> \(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
=> Chọn C
b) \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2SO_4}=\dfrac{0,05}{3}=\dfrac{1}{60}\left(mol\right)\)
=> \(C_{M\left(Al_2\left(SO_4\right)_3\right)}=\dfrac{1}{\dfrac{60}{0,1}}==0,17M\)
=> Chọn A

Cứu em với, giải đầy đủ xíu. theo PTHH đó e
hệ số của Fe2O3 là 1
hệ số của H2 là 3
->n H2=3n Fe2O3
dùng tỉ lệ của hệ số
VD: Tỉ lệ hệ số của Fe2O3 và H2 là 1/3
=> Tỉ lẹ số mol = 1/3 => nFe2O3 = 1/3nH2
=> nH2 = 0,1 : 1/3 = 0,3 (mol)

a) Ta có: O hóa trị II, ta gọi hóa trị Mn cần tìm trong hợp chất MnO2 là x: \(Mn^xO_2^{II}\)
Theo quy tắc hóa trị, ta có:
1.x=2.II
=>x= (2.II)/1= IV
=> Hóa trị x của Mn cần tìm trong hợp chất MnO2 là IV.
a) Ta có: (PO4) hóa trị II, ta gọi hóa trị Mn cần tìm trong hợp chất là y: \(Ba^y_3\left(PO_4\right)^{III}_2\)
Theo quy tắc hóa trị, ta có:
3.y=III.2
=>y=(III.2)/3=II
=> Hóa trị y của Ba cần tìm trong hợp chất Ba3(PO4)2 là II.

PTHH: 2KMnO4 \(\underrightarrow{t^o}\) K2MnO4 + MnO2 + O2\(\uparrow\)
\(n_{KMnO_4}=\dfrac{23,7}{158}=0,15mol\)
\(n_{O_2}=\dfrac{0,15}{2}=0,075mol\\ V_{O_2}=0,075.22,4=1,68l\)
\(\Rightarrow\) Đáp án A
Câu 28:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2\(\uparrow\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\\ n_{Al}=\dfrac{0,3.2}{3}=0,2mol\\ m_{Al}=0,2.27=5,4g\)
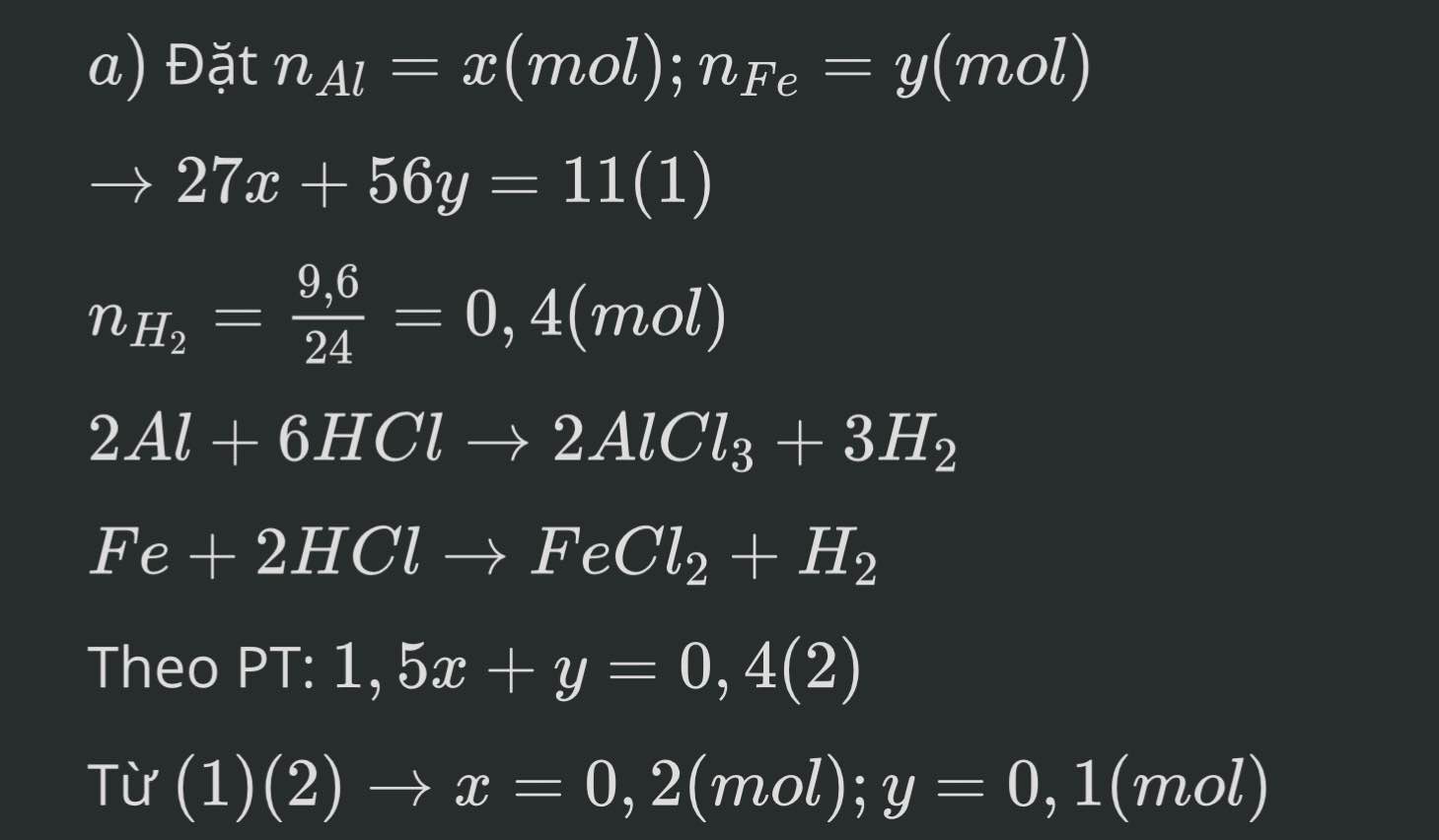




bạn bấm máy tính hoặc giải hệ:
\(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}27x+56y=11\\84x+56y=22,4\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}57x=11,4\\27x+56y=11\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\27.0,2+56y=11\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
bấm hệ của 1 và 2