Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Bảo toàn điện tích:
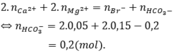
Đun nóng dung dịch Y:
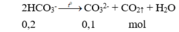
Muối khan trong Y là:
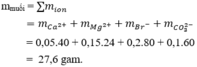

Theo định luật bảo toàn điện tích:
\(a+b=n_{Na^+}+2n_{Mg^{2+}}\Rightarrow a+b=0,4\) (1)
Để đơn giản, ta xét toàn bộ lượng dung dịch X tác dụng với dung dịch AgNO3 dư, ta có:
\(n_{AgCl}=\dfrac{2,1525.10}{143,5}=0,15\left(mol\right)\)
\(Ag^++Cl^-\rightarrow AgCl\downarrow\)
0,15 <-- 0,15
\(\Rightarrow a=n_{Cl^-}=0,15\left(mol\right)\Rightarrow b=0,4-0,15=0,25\left(mol\right)\)
Muối khan thu được khi cô cạn dung dịch X là:
\(m_{\text{muối}}=0,1.23+0,15.24+0,15.35,5+0,25.62=26,725\left(gam\right)\)
Theo định luật bảo toàn điện tích:
\(a+b=n_{Na^+}+2n_{Mg^{2+}}\Rightarrow a+b=0,4\) (1)
Để đơn giản, ta xét toàn bộ lượng dung dịch X tác dụng với dung dịch AgNO3 dư, ta có:
\(n_{AgCl}=\dfrac{2,1525.10}{143,5}=0,15\left(mol\right)\)
\(Ag^++Cl^-\rightarrow AgCl\downarrow\)
0,15 <-- 0,15
\(\Rightarrow a=n_{Cl^-}=0,15\left(mol\right)\Rightarrow b=0,4-0,15=0,25\left(mol\right)\)
Muối khan thu được khi cô cạn dung dịch X là:
\(m_{\text{muối}}=0,1.23+0,15.24+0,15.35,5+0,25.62=26,725\left(gam\right)\)

Đáp án C
n Al 3+ + 2 n Fe 2+ + n Na+ = 2 n SO4 2- + n Cl-
=> 2a + b = 0.8 (1)
m muối = m Al 3++ m Fe 2+ + m Na+ + m SO4 2- + m Cl- = 51,6 g
=> 96 a + 35,5 b = 35 ,9 g (2)
Giải (1) và (2 ) ta có a = 0,3 , b = 0,2

Đáp án A
Bảo toàn điện tích suy ra x = 0,025 mol
Ba2++ SO42-→BaSO4
0,03 0,025 0,025
OH-+ NH+4→ NH3+ H2O
0,06 0,05
Dung dịch Y có 0,12 mol Na+; 0,12 mol Cl-; 0,005 mol Ba2+; OH- 0,01 mol
Khi cô cạn thu được m = 0,12.23+ 0,12.35,5+ 0,005.137+ 0,01.17 = 7,875 gam

Đáp án C
Bảo toàn điện tích: 2x = 0,05 + 0,12 – 0,12 ⇒ x = 0,025
Ba2+ + SO42- → BaSO4
0,025 ← 0,025 → 0,025 (mol)
NH4+ + OH- → NH3 + H2O
0,05 → 0,05 → 0,05 0,05 ( mol)
mchất rắn = mX + mBa(OH)2 – mBaSO4 – mNH3 – mH2O = 7,875g


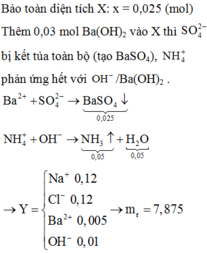
Chọn D
Bảo toàn điện tích: 2.0,05 + 2.0,15 = 0,2 + y → y = 0,2 mol
Đun nóng Y:
Khối lượng muối khan: 0,05.137 + 0,15.24 + 0,2.35,5 + 0,1.60 = 23,55 gam.