Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(\left[Na^+\right]=0,1\)
\(\left[K^+\right]=0,1\)
\(\left[OH^-\right]=0,2\)
\(\left[SO_4^{2-}\right]=0,2\)
\(\left[H^+\right]=0,4\)
b, \(n_{H^+}=0,1.0,4=0,04\left(mol\right)\)
\(n_{OH^-}=0,1.0,2=0,02\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(\Rightarrow n_{H^+dư}=0,02\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,02}{200}=10^{-4}\)
\(\Rightarrow pH=4\)

$n_{NaOH} = n_{KOH} = 0,1.0,1 = 0,01(mol)$
$n_{H_2SO_4} = 0,02(mol)$
OH- + H+ → H2O
Bđ : 0,01...0,04..................(mol)
Pư : 0,01...0,01...................(mol)
Sau pư : 0......0,03...................(mol)
$V_{dd} = 0,1 + 0,1 = 0,2(lít)$
Vậy :
$[K^+] = [Na^+] = \dfrac{0,01}{0,2} = 0,05M$
$[H^+] = \dfrac{0,03}{0,2} = 0,15M$
$[SO_4^{2-}] = \dfrac{0,02}{0,2} = 0,1M$
b)
$pH = -log(0,15) = 0,824$

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
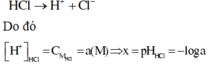
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
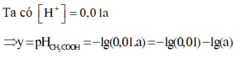
![]()
Đáp án A.

2. Tính nồng độ mol/l của các dung dịch:
a) Dung dịch H2SO4 có pH = 4.
\(pH=4\Rightarrow\left[H^+\right]=10^{-4}M\)
=> \(CM_{H_2SO_4}=\dfrac{\left[H^+\right]}{2}=\dfrac{10^{-4}}{2}=5.10^{-5M}\)
b) Dung dịch KOH có pH = 11.
\(pH=11\Rightarrow pOH=14-11=3\)
=> \(\left[OH^-\right]=10^{-3}=CM_{KOH}\)
3. Pha loãng 200ml dung dịch Ba(OH)2 với 1,3 lít nước thu được dung dịch có pH = 12. Tính nồng độ mol/l của dung dịch Ba(OH)2 ban đầu, biết rằng Ba(OH)2 phân ly hoàn toàn.
Đặt CM Ba(OH)2 = xM
=> \(n_{Ba\left(OH\right)_2}=0,2x\left(mol\right)\)
\(V_{sau}=V_{Ba\left(OH\right)_2}+V_{H_2O}=0,2+1,3=1,5\left(l\right)\)
pH=12 => pOH=2 => \(\left[OH^-\right]=10^{-2}M\)
\(Ba\left(OH\right)_2\rightarrow Ba^{2+}+2OH^-\)
0,2x----------------------------->0,4x
=> \(\left[OH^-\right]=\dfrac{0,4x}{1,5}=10^{-2}\)
=> x=0,0375M
Vậy nồng độ mol/l của dung dịch Ba(OH)2 ban đầu là 0,0375M

Vì phản ứng tạo ra bạc nên phải có \(\text{HCOOH}\) . Theo bài ra ta có
\(\begin{cases}n_{HCOOH}=2.\left(\frac{21,6}{4.108}\right)\\n_{HCOOH}+n_{RCOOH}=2.\left(\frac{200.1}{1000}\right)\end{cases}\)\(\rightarrow\begin{cases}n_{HCOOH}=0,1mol\\n_{RCOOH}=0,3mol\end{cases}\)\(\rightarrow M_{RCOOH}=\frac{26,8-0,1.46}{0,3}\)
\(\Rightarrow M_R=29\Rightarrow R:C_2H_5\Rightarrow C\) là đáp án đúng