Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Bảo toàn điện tích suy ra x = 0,025 mol
Ba2++ SO42-→BaSO4
0,03 0,025 0,025
OH-+ NH+4→ NH3+ H2O
0,06 0,05
Dung dịch Y có 0,12 mol Na+; 0,12 mol Cl-; 0,005 mol Ba2+; OH- 0,01 mol
Khi cô cạn thu được m = 0,12.23+ 0,12.35,5+ 0,005.137+ 0,01.17 = 7,875 gam

Đáp án C
Bảo toàn điện tích:
0,12.1 + 0,05.1 = 0,12.1 + 2x
Þ x = 0,025
![]()
![]()
![]()
![]()
![]()
![]()
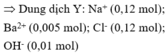
m = 0,12.23 + 0,005.137 + 0,12.35,5 + 0,01.17 = 7,875 (gam)

Đáp án C
Bảo toàn điện tích: 2x = 0,05 + 0,12 – 0,12 ⇒ x = 0,025
Ba2+ + SO42- → BaSO4
0,025 ← 0,025 → 0,025 (mol)
NH4+ + OH- → NH3 + H2O
0,05 → 0,05 → 0,05 0,05 ( mol)
mchất rắn = mX + mBa(OH)2 – mBaSO4 – mNH3 – mH2O = 7,875g

AD ĐLBT e, ta có:
0,12.1 + 0,05.1 = 0,12.1 + x.2
=> x = 0,025 (mol)
Cho Ba(OH)2 vào dd X
nBa2+ = 0,3.0,1 = 0,03
nOH- = 0,3.0,1.2 = 0,06
Ba2+ + SO42- ---> BaSO4
0,03...0,025...---> 0,025
=> nBa2+ dư = 0,005
NH4+ + OH- ---> NH3 + H2O
0,05...0,06...-->...0,05
=> nOH- dư = 0,01
\(\sum m=\)mNa+ + mCl- + mBa2+ dư + mOH- dư
= 0,12.23 + 0,12.35,5 + 0,05.137 + 0,01.17
= 7,875(g)

Theo BTĐT: x = ( 0,12 + 0 ,05 - 0,12):2 = 0,025 (mol)
Cho 0 ,03 Ba(OH)2 vào dd X
Ba2+ + SO42- --->BaSO4
NH4+ OH- ---> NH3 +H2O
=> m = 7,875g
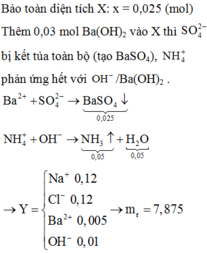






Bảo toàn điện tích : $x = \dfrac{0,12 + 0,05 - 0,12}{2} = 0,025(mol)$
$n_{Ba^{2+}} = n_{Ba(OH)_2} = 0,3.0,1 = 0,03(mol)$
$n_{OH^-} = 2n_{Ba(OH)_2} = 0,06(mol)$
$Ba^{2+} + SO_4^{2-} \to BaSO_4$
$NH_4^+ + OH^- \to NH_3 + H_2O$
Suy ra, dung dịch gồm :
$Na^+ : 0,12(mol)$
$Cl^- : 0,12(mol)$
$OH^- : 0,06 - 0,05 = 0,01(mol)$
$Ba^{2+} : 0,03 - 0,025 = 0,005(mol)$
Suy ra: $m = 0,12.23 + 0,12.35,5 + 0,01.17 + 0,005.137 = 7,875(gam)$