Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nOH-=0,5.2.0,2=0,2 mol
mHCL=200.1,05=210g=> mHCL=210.10/100=21g
n H+=nHCL=21/36,5=0,57 mol =>nH+>nOH-=>dd thu được có tính axit
nBa(OH)2 = 0.2*0.5=0.1 mol
mddHCl= V*d=200*1.05=210g
=> mHCl =210*10/100=21g
=> nHCl =21/36.5=\(\dfrac{42}{73}\) \(\approx\) 0.575mol
PTHH: 2HCl + Ba(OH)2 ----> BaCl2 + H2O
\(\dfrac{42}{73}\) 0.1
Ta thấy HCl dư \(\dfrac{137}{730}\) mol
Vậy dd thu được vẫn còn axit.

1 lít nước nặng 1000 g, nên số mol nước trong 1000 g là 55,5 mol.
Cứ có 55,5 mol nước ở 25 ° C thì có 1. 10 - 7 mol phân li ra ion. Phần trăm mol nước phân li ra ion :
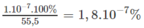
1,8. 10 - 7 % mol H 2 O phân li ra ion cũng là phần trăm số phân tử H 2 O phân li ra ion.

Thu nhiệt, vì khi nhiệt độ tăng tích số ion của nước tăng, nghĩa là sự điện ỉi của nước tăng, tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê.

_Dung dịch HCl và HNO3 có pH=1:
=>[H+] = 10^-1 (mol/l)
=>Σ nH{+} = 10^-1*0.1 = 0.01(mol)
+nNaOH = 0.1a (mol)
NaOH => Na{+} + OH{-}
0.1a.........0.1a.......0.1a(mol)
=>nOH{-} = 0.1a (mol)
_Sau phản ứng thu được dung dịch có pH = 12:
+pH = 12:môi trường có tính bazơ => bazơ dư , axit hết.
+pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10^-2 (mol/l)
=>nOH{-} dư = 10^-2*0.2 = 2*10^-3 (mol)
H{+} + OH{-} => H2O
0.01....0.1a
0.01....0.01........0.01(mol)
..0....0.1a - 0.01.0.01(mol)
=>nOH{-} dư = 0.1a - 0.01 = 2*10^-3 (mol)
<=>0.1a = 0.012
<=>a = 0.12
Vậy a = 0.12 (M)
Đáp án: B.