Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Khi cho dung dịch K2CO3 vào dung dịch X thì có các phản ứng:
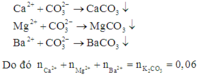
Áp dụng định luật bảo toàn điện tích cho dung dịch X ta có:
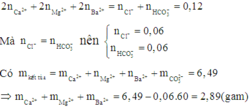
Khi đun nóng dung dịch X rồi nung trong không khí đến khối lượng không đổi thì có các phản ứng:
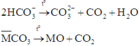
Với M là công thức chung của Ca, Mg và Ba.
Do đó chất rắn khan thu được cuối cùng chứa Ca2+, Mg2+, Ba2+, Cl-, O2- (trong oxit) với
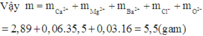

Đáp án D
BTĐT: nNO3- = nNa+ + 2nBa2+ + 2nMg2+ - nCl- = 0,3.1+0,1.2+0,05.2-0,2.1=0,4 mol
m muối = mNa+ + mBa2+ + mMg2+ + mCl- + mNO3- = 0,3.23+0,1.137+0,05.24+0,2.35,5+0,4.62 = 53,7 gam

Đáp án B
-Cho ½ dung dịch X phản ứng với dung dịch NaOH dư
HCO3-+ OH- →CO32-+ H2O
Ca2++ CO32- dư →CaCO3
0,02 0,02
- Cho ½ dung dịch X phản ứng với dung dịch Ca(OH)2 dư
HCO3-+ OH- →CO32-+ H2O
0,045 0,045
Ca2++ CO32- →CaCO3
0,045 0,045
Dung dịch X có 0,07 mol Cl-; 0,04 mol Ca2+; 0,09 mol HCO3-; 0,08 mol Na+
Đun sôi dung dịch X thì: 2HCO3- → CO32-+ H2O + CO2
0,09 0,045 0,045 0,045
m = (0,07.35,5+0,04.40+ 0,09.61+ 0,08.23-0,045.18-0,045.44) = 8,625 gam

Đáp án D
Áp dụng định luật bào toàn điện tích cho dung dịch ban đầu ta có
![]()
Khi cô cạn dung dịch thì có phản ứng sau xảy ra
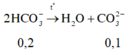
Sau khi dung dịch đã bay hơi hết nước và cô cạn chất rắn tới khối lượng lượng không đổi, nên có phản ứng sau:
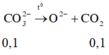
Chú ý: Cách viết phương trình trên không đúng với bản chất hóa học do chất rắn không thể viết được dưới dạng ion nhưng ta có thể viết để có thể đơn giản cách giải trở nên nhanh chóng trong các bài tập trắc nghiệm.
Tuy nhiên các bạn cũng cần lưu ý rằng muối cacbonat của kim loại kiềm không bị nhiệt phân nên lượng muối cacbonat bị nhiệt phần chỉ tương ứng với ion Ca2+ (muối CaCO3) nên nếu thì ![]()
còn lại vẫn tồn tại dưới dạng muối cacbonat của kim loại kiềm. Do vậy nếu không nắm chắc bản chất phản ứng, các bạn vẫn nên viết phản ứng nhiệt phân muối cacbonat dạng phân tử:
![]()
Do đó khối lượng chất rắn thu được cuối cùng là tổng khối lượng của 0,1 mol CaO và 0,2 mol NaCl.
Vậy khối lượng của chất rắn là
m = 0,1.56+0,2.58,5 = 17,3 (gam)

Đáp án A
Áp dụng định luật bảo toàn điện tích ta có:
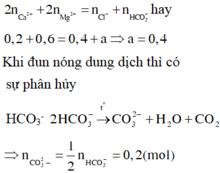
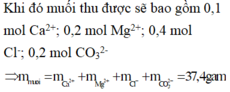
Đáp án A.

Đáp án A
Theo ĐLBT ĐT thì 0,2.1+ 2x+ 0,3=0,7 suy ra x=0,1 mol
AgNO3→ Ag+ NO2+ ½ O2
Cu(NO3)2 →CuO+ 2NO2+ ½ O2
KNO3 →KNO2+ ½ O2
Chất rắn Y chứa Ag: 0,2 mol; CuO: 0,1 mol; KNO2: 0,3 mol
m=0,2.108+ 0,1.80+ 0,3.85=55,1 gam

Đáp án B
Ta thấy dung dịch tồn tại hỗn hợp 2 axit HNO3 và H2SO4
Vì H2SO4 là một axit khó bay hơi
Mặt khác khi cô cạn dung dịch muối cũng không bay hơi
Do đó chất bị bay hơi chỉ có thể là HNO3



Đáp án A
Theo định luật bảo toàn điện tích: 0,1.2+ 0,3.2= 0,4.1+y suy ra y= 0,4 mol
Khi đun nóng thì 2HCO3- CO32-+ CO2+ H2O
0,4 0,2 mol
Khối lượng muối khan thu được là:
0,1.40+ 0,3.24+ 0,4.35,5+ 0,2.60= 37,4 gam

