Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.\(Fe+S\rightarrow\left(t^o\right)FeS\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
b.\(n_{hhk}=\dfrac{4,48}{22,4}=0,2mol\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
Ta thu được hh khí --> S hết, Fe dư
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\\n_S=y\end{matrix}\right.\)
\(\rightarrow n_{FeS}=n_{Fe}=n_S\rightarrow n_{Fe\left(dư\right)}=x-y\) ( mol )
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(x-y\) \(x-y\) ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
y y ( mol )
Ta có: \(\left(x-y\right)+y=0,2\)
\(\Leftrightarrow x=0,2\)
Ta có:\(56x+32y=14,4\)
\(\Leftrightarrow56.0,2+32y=14,4\)
\(\Leftrightarrow y=0,1\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{14,4}.100=77,77\%\\\%m_S=100\%-77,77\%=22,23\%\end{matrix}\right.\)

a, Do cho hỗn hợp A tác dụng với dung dịch HCl dư tạo ra hỗn hợp khí
\(\Rightarrow\) sau phản ứng cháy của Fe và S thì Fe còn dư
Đặt nFe=nS =amol và nFe(dư) = bmol
Fe + S \(\rightarrow\)![]() FeS (đk:nhiệt độ)
FeS (đk:nhiệt độ)
amol .... amol ........amol
|
FeS + 2HCl amol ...........................amol Fe + 2HCl bmol............................bmol |
2H2S + 3O2 amol ......................... amol 2H2+O2 bmol .........bmol |
H2O2+SO2![]() \(\rightarrow\)H2SO
\(\rightarrow\)H2SO
bmol ..... bmol .... bmol
b) Áp dụng theo quy tắc đường chéo ta có
\(=\frac{8}{24}=\frac{1}{3}=\frac{mH2}{mH2S}\Rightarrow\frac{b}{a}=\frac{1}{3}\rightarrow a=3b\)
mhỗn hợp đầu = mFe + mS = (a + b).56 + a.32 = 320b (gam)
mS = a.32 = 96b (gam) ![]()
\(\Rightarrow\sum n_Y=0,1\left(mol\right)\underrightarrow{\frac{nH2S}{nH2}=\frac{3}{1}}\left\{{}\begin{matrix}nH2=b=0,025\left(mol\right)\\nH2S=a=0,075\left(mol\right)\end{matrix}\right.;nH2O2=\frac{V.D.C\%}{MH2O2}=0,15mol\)
\(nH2O2=15-b=0,075\left(mol\right)\)
![]()
\(mddB=100.1+0,075.64+0,025.18=105,25g\)
\(C\%H2SO4=\frac{0,075.98}{105,25}.100\%=6,983\%\)
\(C\%H2O2=\frac{0,075.34}{105,25}.100\%=2,423\)
![]()
![]()
![]()
![]()
![]()
![]()
![]()

Đáp án A
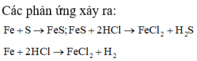
Hỗn hợp khí Z gồm H2S và H2. Đặt nFe=1mol . Dựa vào phương trình phản ứng ta thấy vì số mol khí sinh ra luôn là 1 mol với bất kì hiệu suất và tỉ lệ a:b nào nên:
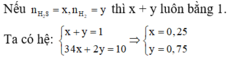
Theo đề bài hiệu suất phản ứng là 50% nhưng do chưa biết Fe hay S dư nên phải xét hai trường hợp. Tuy nhiên khi nhìn vào đáp án có thể thấy số mol sắt lớn hơn số mol lưu huỳnh nên hiệu suất được tính theo lưu huỳnh. Bảo toàn lưu huỳnh suy ra
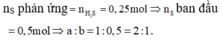
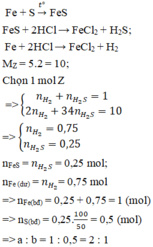
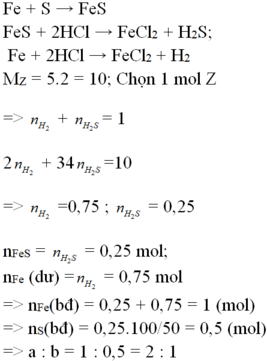


a) PTHH : Fe + S \(\rightarrow\) FeS
=> A gồm : Fe , FeS
Fe + 2 HCl -> FeCl2 + H2
FeS + 2 HCL -> FeCl2 + H2S
=> Y gồm : H2 , H2S
nY = n H2 + n H2S = 0,1 mol (I)
dY/H2 = 13 -> m Y = 2.nH2 + 34.n H2S = 13.2.0,1 = 2,6 g (II)
Từ (I),(II) => n H2 = 0,025 mol ; n H2S = 0,075 mol
Fe + 2 HCl \(\rightarrow\) FeCl2 + H2
0,025<---------------------0,025 mol
FeS + 2 HCl \(\rightarrow\) FeCl2 + H2S
0,075<-------------------------0,075 mol
Ta có: n S = n Fe phản ứng = n FeS = 0,075 mol
=>m S =0,075.32 = 2,4 g
n Fe ban đầu = 0,075 + 0,025 = 0,1mol
=>m Fe=0,1.56 = 5,6 g
=> %m S = \(\dfrac{2,4}{2,4+5,6}.100=30\%\)
=> %m Fe = 100 - 70 = 30%
b ) 2 H2 + O2 \(\rightarrow\) 2 H2O
0,025-------------->0,025 mol
2 H2S + 3 O2 \(\rightarrow\) 2 SO2 + 2 H2O
0,075--------------->0,075--->0,075 mol
m H2O2 = 5,1 g -> n H2O2 = 0,15 mol
PTHH : SO2 + H2O2 \(\rightarrow\) H2SO4
Ban đầu :0,075---->0,15 mol
Phản ứng:0,075--->0,075------>0,075 mol
Sau phản ứng:0----->0,075----->0,075 mol
m dd sau phản ứng = 18.(0,025 + 0,075 ) + 64.0,075 + 100 = 106,6 g
m H2O2 dư = 0,075.34 =2,55g
\(\Rightarrow C\%_{H_2O_2dư}=\dfrac{2,55}{106,6}.100=2,392\%\)
m H2SO4 = 0,075.98 = 7,35g
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{7,35}{106,6}.100=6,895\%\)
lm ntn để ra mH2O2=5.1g ạ