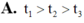Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$a)$
Hiện tượng: mẩu giấy bị mất màu
$Cl_2+H_2O\leftrightharpoons HCl+HClO$
$b)$
Hiện tượng: tạo kết tủa trắng, sau khi đưa ra ánh sáng thì kết tủa hóa đen
$AgNO_3+NaCl\to AgCl\downarrow+NaNO_3$
$2AgCl\xrightarrow{ánh\, sáng}2Ag+Cl_2$
$c)$
Hiện tượng: tàn đóm bùng cháy (do có $O_2$)
$2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\uparrow$
$d)$
Hiện tượng: sinh ra iot làm xanh hồ tinh bột
$Cl_2+2KI\to 2KCl+I_2$

Đáp án D
Phương trình phản ứng: Na 2 S 2 O 3 + H 2 SO 4 → Na 2 SO 4 + S ↓ + SO 2 ↑ + H 2 O
Nồng độ chất tham gia phản ứng càng cao (nồng độ các chất trong dung dịch hỗn hợp khi trộn các chất với nhau), tốc độ phản ứng càng nhanh, thời gian kết tủa càng ngắn.
Ở đây, nồng độ dung dịch H2SO4 được giữ cố định (1 giọt), do đó trong dung dịch hỗn hợp thu được nồng độ H2SO4 không đổi, dẫn đến tốc độ phản ứng chỉ còn phụ thuộc vào nồng độ Na2S2O3.
Thứ tự tăng nồng độ Na2S2O3 trong các thí nghiệm sau: thí nghiệm 2 (12 giọt Na2S2O3 + 0 giọt H2O) > thí nghiệm 3 (8 giọt Na2S2O3 + 4 giọt H2O) > thí nghiệm 1 (4 giọt Na2S2O3 + 8 giọt H2O).
Vậy thời gian xuất hiện kết tủa theo thứ tự là t 1 > t 3 > t 2 .

Đáp án D
Phương trình phản ứng: Na 2 S 2 O 3 + H 2 SO 4 → Na 2 SO 4 + S ↓ + SO 2 ↑ + H 2 O
Nồng độ các chất phản ứng là Na2S2O3 và H2SO4 không đổi, do đó tốc độ phản ứng chỉ phụ thuộc nhiệt độ. Khi nhiệt độ tăng, tốc độ phản ứng tăng và thời gian phản ứng giảm.
Nhiệt độ ở các thí nghiệm tăng theo thứ tự sau: thí nghiệm 1 < thí nghiệm 3 < thí nghiệm 2, do đó tốc độ phản ứng thí nghiệm 1 < thí nghiệm 3 < thí nghiệm 2 và thời gian phản ứng thí nghiệm 1 > thí nghiệm 3 > thí nghiệm 2 => t 1 > t 3 > t 2 .

- Thí nghiệm 1:
+ Khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu thì tạo ra dung dịch màu vàng nâu của bromine:
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
+ Khi nhỏ 2 mL cyclohexane vào ống nghiệm, quan sát thấy màu vàng nâu của bromine nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
- Thí nghiệm 2:
+ Khi cho nước bromine màu vàng vào dung dịch sodium iodine không màu thì tạo ra dung dịch màu vàng:
Br2(aq) + 2NaI(aq) → 2NaBr(aq) + I2(aq)
+ Khi cho thêm 2 mL cyclohexane thấy màu dung dịch nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
+ Khi thêm tiếp vài giọt hồ tinh bột thì thấy dung dịch từ màu vàng chuyển sang màu xanh tím do iodine tác dụng với hồ tinh bột

Nhận xét:
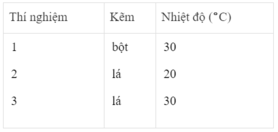
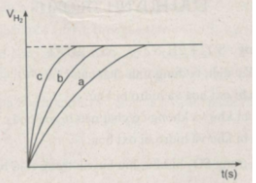
- Khí hiđro được giải phóng ở thí nghiệm 1 nhiều, nhanh hơn ở thí nghiệm 3. Vì diện tích tiếp xúc của Zn với H 2 SO 4 ở thí nghiệm 1 lớn hơn. trong khi đó nhiệt độ của dung dịch axit là như nhau.
- Khí hiđro được giải phóng ở thí nghiệm 3 nhiều, nhanh hơn ở thí nghiệm 2. Vì nhiệt độ của dung dịch H 2 SO 4 ở thí nghiệm 3 cao hơn, trong khi đó diện tích tiếp xúc giữa Zn và axit là như nhau.