Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Mol Mg = mol Fe = 0,08 và mol HCl = 0,24
Mg - 2e ---> Mg2+
0,08--0,16
Fe - 3e ---> Fe3+
0,08--0,24
Cl2 + 2e ---> 2 Cl-
a-----2a---------2a
O2 + 4e ---> 2 O2-
b-------4b--------2b
Ag+ + e ---> Ag
x--------x---------x
2 H+ + O2- --> H2O
0,24----0,12
mol O = 2b = 0,12 ==>> b = 0,06
Bảo toàn mol e : 2a + 4b + x = 0,16 + 0,24 = 0,40 ==> 2a + x = 0,16
Kết tủa gồm : AgCl (2a + 0,24) mol và Ag x mol
==> 143,5(2a+0,24) + 108x = 56,69 ==> 287a + 108x = 22,25
===> a = 0,07 và x = 0,02
==> X gồm 0,07 mol Cl2 và 0,06 mol O2 ===> %mol O2 = 46,15

Chọn C
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
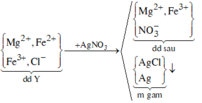
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%

Đáp án B
Có m h h k h í = 6,11; n h h k h í = 0,13
=> n C l 2 = 0,05; n O 2 = 0,08.
Hòa tan hết Y trong HCl nên có: n H C l = 2. n H 2 O = 2. n O 2 - = 0,32 mol
- BTNT (Cl):
n C l - t r o n g Z = n A g C l = n H C l + n C l - = 0,32 + 0,1 = 0,42. → m A g C l = 0,42.143,5 = 60,27 gam
→ m k ế t t ủ a = m A g C l + m A g → m A g = 73,23 – 60,27 = 12,96 → n A g = 0,12 mol.
=> n F e 2 + = 0,12.
BTĐT trong Z: 2.0,12 + 2. n C u = 0,42 => n C u = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n N O = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n H N O 3 = 4 n N O = 0,6 mol → m H N O 3 = 37,8 → m d d H N O 3 = 120 gam.
→ BTKL: m d d T = m X + m H N O 3 - m N O = 127,98 gam.
% C F e ( N O 3 ) 3 t r o n g T = 0,03 . 242 : 127,98 ≈ 5,67%.

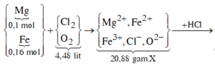
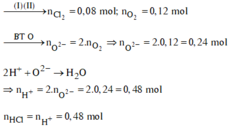
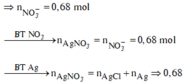


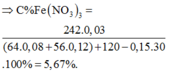

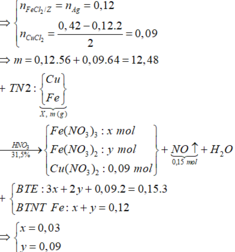

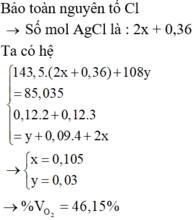

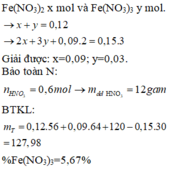
Ta có nFe = 0,18; nMg = 0,15
Đặt số mol O2 = a, nCl2 = b, ta có 32a + 71b = 19,6 gam (1)
Đặt số mol Fe2+ là x, số mol Fe3+ là y, vì HCl vừa đủ và AgNO3 dư nên kết tủa có cả Ag và AgCl
Ta có: x + y = 0,18
2x + 3y + 0,5.2 = (119,12 - 108.x) : 143,5
(phương trình thứ 2 có nghĩa là số mol muối AgCl (có khối lượng là 119,12 - mAg, mAg tính thông qua Fe2+, sau đó bảo toàn e ta có pt 2)
=> x = 0,04 => y = 0,14 mol
từ đây ta có phương trunh:
4a + 2b = 0,04.2 + 0,14.3 + 0,15.2 = 0,8
=> a = 0,08 và b = 0,24
=> % số mol Cl2 = 80%
=> Đáp án A