Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Định hướng tư duy giải
Ta có:
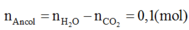
→ từ số mol CO2 suy ra ancol là CH3OH
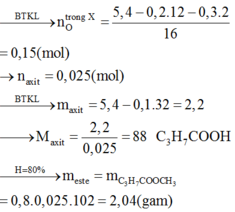

Đáp án B
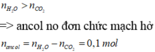
Áp dụng định luật bảo toàn khối lượng cho phản ứng đốt cháy ta có:
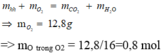
Áp dụng định luật bảo toàn nguyên tố oxi:
nO trong ancol + nO trong axit + nO trong O2
= nO trong CO2 + nO trong H2O
=> nO trong axit = 2.0,3 + 0,4 - 0,1 - 0,8 = 0,1 mol
=> naxit= 0,05 mol
Gọi m, n lần lượt là số ntử C của ancol, axit m ≠ n
=> 0,1m + 0,05n = 0,3
=> m =1, n=4
=> CTPT: CH3OH, C3H7COOH
=> CT este C3H7COOCH3
=> phản ứng este hóa, ancol dư 0,05 mol, axit hết
=> meste lí thuyết = 005.102 = 5,1 g
=> meste thực tế = 5,1.80% = 4,08g

Chọn đáp án D
7,6(g) X + ?O2 → 0,3 mol CO2 + 0,4 mol H2O. Bảo toàn khối lượng:
||⇒ mO2 = 0,3 × 44 + 0,4 × 18 - 7,6 = 12,8(g) ⇒ nO2 = 0,4 mol. Bảo toàn nguyên tố Oxi:
nO/X = 0,3 × 2 + 0,4 – 0,4 × 2 = 0,2 mol. Do nCO2 < nH2O ⇒ ancol no, đơn chức, mạch hở.
Ta có: nCO2 – nH2O = (k – 1).nHCHC (với k là độ bất bão hòa của HCHC).
► Áp dụng: nancol = ∑nH2O - ∑nCO2 = 0,1 mol ⇒ naxit = (0,2 - 0,1) ÷ 2 = 0,05 mol.
Đặt số C của axit và ancol là a và b ⇒ 0,1a + 0,05b = 0,3 → a ≠ b a , b ≥ 1 a = 1 và b = 4
⇒ X gồm HCOOH và C4H9OH. Do naxit < nancol ⇒ hiệu suất tính theo axit.
► Este là HCOOC4H9 với số mol 0,04 ⇒ m = 0,04 × 102 = 4,08(g) ⇒ chọn D



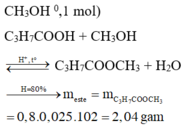


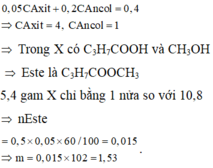
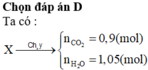
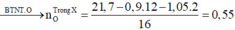
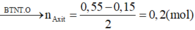

Chọn đáp án A
Ta có : → từ số mol CO2 suy ra ancol là CH3OH
→ từ số mol CO2 suy ra ancol là CH3OH