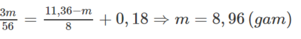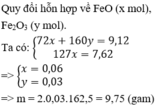Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

FeO + 2HCl => FeCl2 + H2O
Fe2O3 + 6HCl => 2FeCl3 + 3H2O
Quy đổi hỗn hợp chỉ gồm : FeO , Fe2O3
nFeCl2 = 7.62/127 = 0.06 (mol)
=> nFeO = nFeCl2 = 0.06 (mol)
mFeO = 0.06*72 = 4.32 (g)
mFe2O3 = 9.12 - 4.32 = 4.8 (g)
nFe2O3 = 4.8/160 = 0.03 (mol)
nFeCl3 = 2nFe2O3 = 0.06 (mol)
mFeCl3 = 0.06*162.5 = 9.75 (g)

Bạn xem lại đề: 8,6 g Fe sao đốt ra chỉ thu được 7,36 g hỗn hợp

Bảo toàn Fe: nFe(bđ) = 0,012 + 0,12 + 0,01.3 + 0,01.2 = 0,182 (mol)
=> m = 0,182.56 = 10,192 (g)

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

Coi hh gồm Fe và O.
Ta có: 56nFe + 16nO = 14,64 (1)
Ta có: \(n_{NO}=\dfrac{1,4874}{24,79}=0,06\left(mol\right)\)
Theo ĐLBT e, có: 3nFe = 2nO + 3nNO ⇒ 3nFe - 2nO = 0,06.3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,201\left(mol\right)\\n_O=0,2115\left(mol\right)\end{matrix}\right.\)
⇒ m = mFe = 0,201.56 = 11,256 (g)

- Từ quá trình phản ứng ta thấy số oxi hoá của các chất phản ứng ở trạng thái đầu là
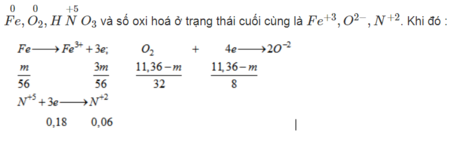
Áp dụng ĐLBT electron ta có: