Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi hh X gồm Fe và O.
Ta có: 56nFe + 16nO = m1 (1)
\(n_{NO}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
BT e, có: 3nFe - 2nO = 3nNO = 0,06 (2)
BTNT Fe, có: nFe(NO3)3 = nFe ⇒ 242nFe = m1 + 16,68 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_O=0,12\left(mol\right)\\m_1=7,52\left(g\right)\end{matrix}\right.\)
BTNT N, có: nHNO3 (pư) = 3nFe(NO3)3 + nNO = 0,1.3 + 0,02 = 0,32 (mol)
⇒ nHNO3 = 0,32 + 0,32.25% = 0,4 (mol)
\(\Rightarrow m_{ddHNO_3}=\dfrac{0,4.63}{25\%}=100,8\left(g\right)\)

Chọn A
Cách 1:
Giả thiết hỗn hợp ban đầu được tạo ra từ a mol Fe và b mol O 2
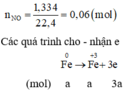

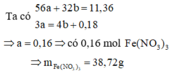
Cách 2:
Quy đổi hỗn hợp về Fe (x mol) và O (y mol)
→ 56x + 16y = 11,36 mol (1)
Bảo toàn e: 3nFe = 2nO + 3 nNO
→ 3x – 2y = 0,18 (2)
Từ (1)(2) → x = 0,16; y = 0,15
Số mol NO3- = ne cho = 3 nFe = 0,48 mol
mmuối = mFe + mNO3- = 0,16.56 + 0,48.62 = 38,72g

Coi hh gồm Fe và O.
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_O=y\left(mol\right)\end{matrix}\right.\)
Ta có: 56x + 16y = 11,36 (1)
Ta có: \(n_{NO}=\dfrac{1,4874}{24,79}=0,06\left(mol\right)\)
Các quá trình:
\(Fe^0\rightarrow Fe^{+3}+3e\)
x_____________3x (mol)
\(O^0+2e\rightarrow O^{-2}\)
y_____2y (mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
______0,18___0,06 (mol)
BT e, có: n e nhường = n e nhận ⇒ 3x = 2y + 0,18 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,16\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
X chứa muối Fe(NO3)3.
BTNT Fe, có: nFe(NO3)3 = nFe = 0,16 (mol)
⇒ mFe(NO3)3 = 0,16.242 = 38,72 (g)

- Từ quá trình phản ứng ta thấy số oxi hoá của các chất phản ứng ở trạng thái đầu là
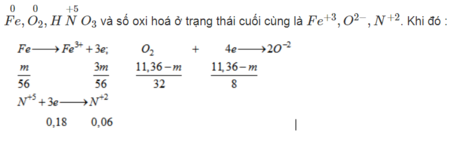
Áp dụng ĐLBT electron ta có:
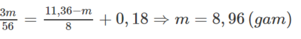

\(n_{H^+} = n_{HCl} + n_{HNO_3} = 0,4 + 0,4.1,2 = 0,88\)
\(Gọi\ n_{Fe} = a ;n_O = b ; n_{NO} = c\)
Suy ra :
56a + 16b = 12,48(1)
Bảo toàn electron : 3a = 2b + 3c(2)
\(n_{H^+\ pư} = 2n_O + 4n_{NO} = 2b + 4c(mol)\\ n_{H^+\ dư} = 0,88 - 2b - 4c\)
\(2Fe^{3+} + Cu \to Cu^{2+} + 2Fe^{2+}\\ 3Cu + 8H^+ + 2NO_3^- \to 3Cu^{2+} + 2NO + 4H_2O\)
\(n_{Cu} = 0,12(mol)\)
Theo PTHH :
0,5a + \(\dfrac{3}{8}\)(0,88 - 2b -4c) = 0,12(3)
(1)(2)(3) suy ra a = 0,216 ; b = 0,024 ; c = 0,2
Suy ra V = 0,2.22,4 = 4,48(lít).Đáp án B

Coi \(n_{Cu} = n_{FeO} = 1(mol)\\ n_{Fe} = x(mol)\)
Bảo toàn electron cho quá trình 1:
\(2n_{Fe} + 2n_{Cu} = 3n_{NO}\)
⇒ 2x + 2 = 3a(1)
Y gồm \(Cu(NO_3)_2,Fe(NO_3)_2\)
Bảo toàn electron cho quá trình 2 :
\(n_{Fe(NO_3)_2} = x + 1 = 3n_{NO}\)
⇒ x + 1 = 3b(2)
Lấy (1) : (2), ta có \(\dfrac{2x + 2}{x + 1} =\dfrac{3a}{3b} \Rightarrow \dfrac{a}{b} = 2\)




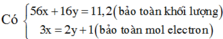
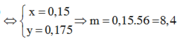
Coi hh gồm Fe và O.
Ta có: 56nFe + 16nO = 14,64 (1)
Ta có: \(n_{NO}=\dfrac{1,4874}{24,79}=0,06\left(mol\right)\)
Theo ĐLBT e, có: 3nFe = 2nO + 3nNO ⇒ 3nFe - 2nO = 0,06.3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,201\left(mol\right)\\n_O=0,2115\left(mol\right)\end{matrix}\right.\)
⇒ m = mFe = 0,201.56 = 11,256 (g)