Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đối với năng lượng của các phân lớp theo nguyên lí vững bền, trường hợp đáp án A sai vì năng lượng của 3d > 4s

a)
- Kim loại có xu hướng nhường electron, phi kim có xu hướng nhận electron
=> Phi kim sẽ lấy electron của kim loại để cả phi kim và kim loại đạt cấu hình electron bền vững của khí hiếm
- Ví dụ: NaCl
+ Na: có 1 electron ở lớp ngoài cùng
+ Cl: có 7 electron ở lớp ngoài cùng
=> Na sẽ nhường 1 electron và Cl sẽ nhận 1 electron của Na để đạt cấu hình có 8 electron ở lớp vỏ ngoài cùng
b)
- Hai phi kim đều có xu hướng nhận thêm electron
=> Cả 2 phi kim sẽ bỏ ra electron để góp chung
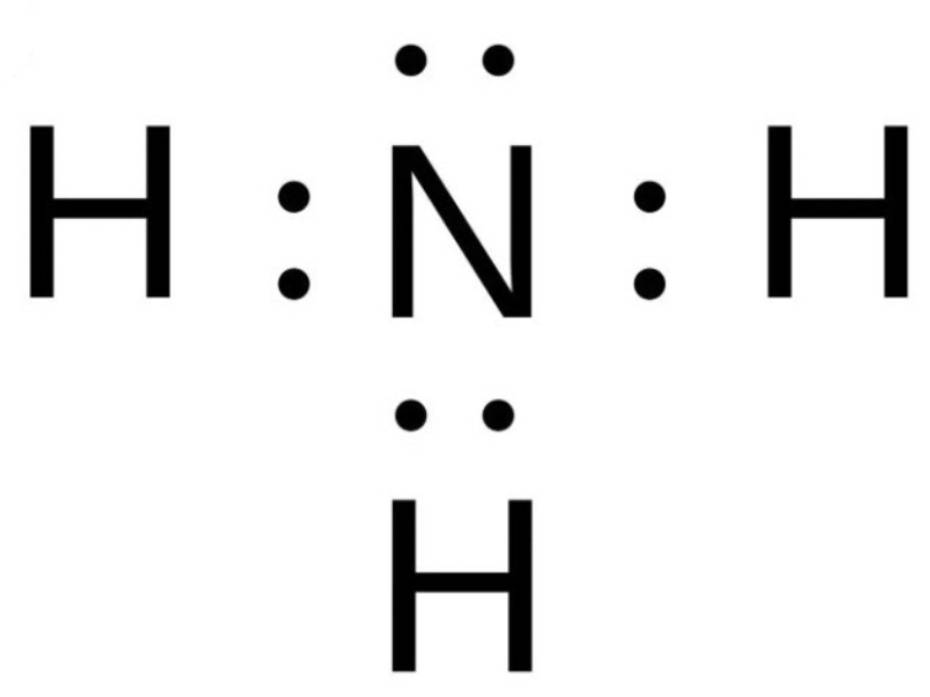
Ví dụ: N2 tác dụng với H2 tạo thành NH3
+ N: có 5 electron ở lớp ngoài cùng => Cần nhận thêm 3 electron
+ H: có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron
=> N sẽ bỏ ra 3 electron và 3H mỗi H bỏ ra 1 electron để góp chung

D
a đúng. Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
b đúng. Các obitan 2 p x , 2 p y , 2 p z định hướng theo các trục x, y, z.
c đúng. Các electron trên cùng một lớp có mức năng lượng xấp xỉ nhau.
d sai. Năng lượng của các electron thuộc các obitan 2s và 2 p x là xấp xỉ nhau
e đúng. Số electron tối đa trên phân lớp d là 10.

mức năng lượng cao nhất là 5s1 vậy thì bạn viết cấu hình e ra : mà như ta đã được biết , trật tự các mức năng lượng theo chiều tăng dần sẽ là : 1s 2p 2s 3p 4s 3d 4p 5s 4d 5p 6s 4f...
vậy cấu hifng sẽ là (z=37)Rb [Kr]5s1 ,số hạt mang điện nhiều hơn số hạt k mang điện 2p - n = 26 => n = 48 => A = 48 + 37 = 85đvc
Tại sao z= 37 vậy ạ. Nếu theo cấu hình e thì z phải bằng 33 chứ ạ.
Đáp án A
Đối với năng lượng của các phân lớp theo nguyên lí vững bền, trường hợp đáp án A sai vì năng lượng của 3d > 4s.