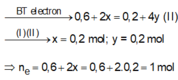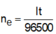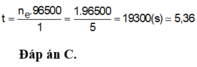K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên
Bảng xếp hạng
Tất cả
Toán
Vật lý
Hóa học
Sinh học
Ngữ văn
Tiếng anh
Lịch sử
Địa lý
Tin học
Công nghệ
Giáo dục công dân
Âm nhạc
Mỹ thuật
Tiếng anh thí điểm
Lịch sử và Địa lý
Thể dục
Khoa học
Tự nhiên và xã hội
Đạo đức
Thủ công
Quốc phòng an ninh
Tiếng việt
Khoa học tự nhiên
- Tuần
- Tháng
- Năm
-
DHĐỗ Hoàn VIP60 GP
-
50 GP
-
41 GP
-
26 GP
-
119 GP
-
VN18 GP
-
14 GP
-
N12 GP
-
H10 GP
-
10 GP