Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

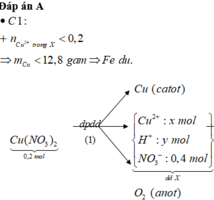
Đáp án : C
nAg+(X) < 0,45 mol
=> mAg tạo ra < 48,6g < 51,42g
=> Chứng tỏ Fe dư => chỉ tạo muối Fe2+
Điện phân :
Catot : Ag+ + 1e -> Ag
(mol) x -> x
Anot : 2H2O -> 4H+ + O2 + 4e
(mol) x <- x
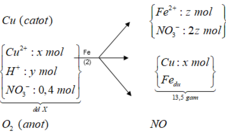
X + Fe :
3Fe + 8H+ + 2NO3- -> 3Fe2+ + 2NO + 4H2O
Fe + 2Ag+ -> Fe2+ + 2Ag
(0,225 – 0,5x) <- (0,45 – x)
=> mrắn sau = mFe dư + mAg
= [ 33,6 – 56.(0,225 – 0,125x)] + 108.(0,45 – x) = 51,42
=> x = 0,18 mol
Có ne = It/F => t = 1,80 h

Khối lượng rắn sau phản ứng = 34,28g => mAg = 0,3*108 = 32,4
=> AgNO3 còn dư sau điện phân 2
AgNO3 + H2O ---> 2 Ag + 0,5 O2 + 2 HNO3x
---------------------x------------------x
Dung dịch sau phản ứng gồm AgNO3 dư 2y mol và HNO3 x mol
Fe + 2 AgNO3 --- Fe(NO3)2+ 2 Ag
y---------------2y---------y3
Fe + 8 HNO3 ----> 3 Fe(NO3)2 + 2 NO + 4 H2O3
x/8------x
số mol AgNO3 : x + 2y = 0,3
khối lượng rắn = 108*2y + 22,4 - 56*(y + 3x/8) = 34,28
=> x = 0,12 và y = 0,09
Thời gian t = 0,12*26,8*1/2,68 = 1,2 giờ
=> Đáp án C

Đáp án B
4AgNO3 + 2H2O ® 4Ag + 4HNO3 + O2
Dung dịch sau điện phân chứa AgNO3 dư = 0,3–x và HNO3 = x mol
Thấy mAg tối đa = 0,3 × 108 = 32,4 < 34,28g → chứng tỏ chất rắn chứa Ag :0,3-x và Fe dư :y
Có nNO = nHNO3 ÷ 4 = 0,25x mol
Bảo toàn electron → 2nFe pư = 3nNO + nAg.
⇒ nFe pư = ( 3×0,25x + 0,3-x) : 2 = 0,15-0,125x
→ 108×(0,3-x) + 22,4 – 56×(0,15-0,125x) = 34,28 ⇒ x = 0,12 mol
⇒ Thời gian điện phân t = 1,2 giờ

Đáp án C
Chất rắn thu được lớn hơn Fe cho vào => dd có Ag+ dư nAg+ đã điện phân = x, nHNO3 = y
Lượng Ag tối đa tạo thành 32,4 g < 34,28g => có Fe dư => Cuối cùng tạo ra Fe2+
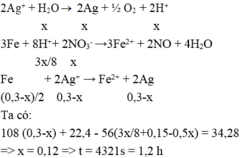
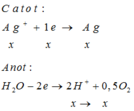
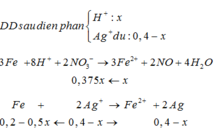
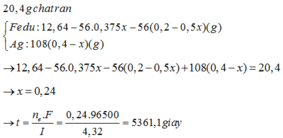

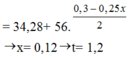

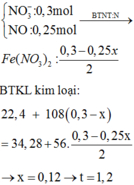

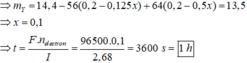
Chọn đáp án C.