Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
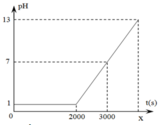
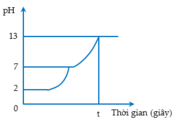
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch X thấy pH của dung dịch tăng dần, chứng tỏ ion dương trong X không bị khử mà nước bị khử, giải phóng H2 và tạo ra O H - .
Điện phân dung dịch thấy pH của dung dịch giảm dần, chứng tỏ ion âm trong Y không bị oxi hóa mà nước bị oxi hóa, giải phóng O2 và tạo ra ion H + . Vậy X là BaCl2 và Y là AgNO3.
Phương trình phản ứng:
B a C l 2 + 2 H 2 O → c ó m à n g n g ă n đ i ệ n p h â n d u n g d ị c h B a ( O H ) 2 + H 2 ↑ + C l 2 ↑ 2 A g N O 3 + 2 H 2 O → đ i ệ n p h â n d u n g d ị c h 2 A g ↓ + H N O 3 + 1 2 O 2 ↑

Đáp án A
Điện phân dung dịch NaCl và HCl (điện cực trơ, màng ngăn xốp). Trong quá trình điện phân, so với dung dịch ban đầu thì giá trị pH của dung dịch thu được tăng lên. Lúc đầu dung dịch có pH nhỏ hơn 7, trong quá trình điện phân, HCl bị điện phân trước làm nồng độ H+ giảm nên pH bắt đầu tăng, khi H+ bị điện phân hết thì dung dịch có pH = 7. Tiếp đó NaCl bị điện phân làm cho nồng độ O H - tăng lên và pH tiếp tục tăng lên lớn hơn 7.
2 H C l → đ i ệ n p h â n d u n g d ị c h H 2 + C l 2 2 N a C l + H 2 O → c ó m à n g n g ă n x ố p đ i ệ n p h â n d u n g d ị c h 2 N a O H + H 2 ↑ + C l 2 ↑

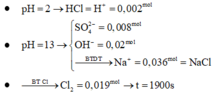
Dd có 0,5a mol CuSO4 và 0,5 mol NaCl.
Trong quá trình điện phân giả sử xảy ra :
+ Catot: Cu2+ → + 2e Cu
2H2O + 2e → 2OH- + H2
+ Anot: 2Cl- → Cl2 + 2e
ne trao đổi = 0,3 mol
=> nCl2= 0,15 mol ; nCu= 0,5a mol ; nH2= (0,3-a) mol
m giảm = m Cl2 + mCu + mH2
=> 17,15 = 71.0,15 + 64.0,5a + 2(0,3-a) => a=0,2 M
=>A


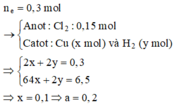

Đáp án A