Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dd có 0,5a mol CuSO4 và 0,5 mol NaCl.
Trong quá trình điện phân giả sử xảy ra :
+ Catot: Cu2+ → + 2e Cu
2H2O + 2e → 2OH- + H2
+ Anot: 2Cl- → Cl2 + 2e
ne trao đổi = 0,3 mol
=> nCl2= 0,15 mol ; nCu= 0,5a mol ; nH2= (0,3-a) mol
m giảm = m Cl2 + mCu + mH2
=> 17,15 = 71.0,15 + 64.0,5a + 2(0,3-a) => a=0,2 M
=>A

Đáp án D
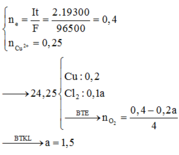
- Nếu cả 2 bị điện phân hết thì mgiảm = 0,05*64 + 0,03*71 > 4.85. vậy:
+ TH1: Cu2+ chưa hết
Catot......................... 0,05 mol CuSO4 + 0,06 mol NaCl...................................... anot
Na+ SO42-
Cu2+ + 2e = Cu 2Cl- = Cl2 + 2e
x → 2x → x 0,06......0,03......0,06
H2O = O2 + 4H + 4e
y......4y......4y
- mgiảm = 64x + 71*0,03 + 32y = 4,85
- BT e: 0,06 + 4y = 2x
- Giải x = 0,04 và y = 0,005
- t = (ne*F):I = 0,08*96500/0,5 = 15440.

Đáp án D
∑ne trao đổi = 0,3 mol < 2nCu2+.
⇒ Cu chưa bị điện phân hết và khí thoát ra là Cl2 và có thể có cả O2.
Nếu chỉ có khí Cl2 ⇒ Quy đổi mDung dịch giảm = mCuCl2 = 0,15×135 = 20,25 ≠ 14,75 ⇒ Loại.
+ Vậy có cả O2 thoát ra ⇒ mDung dịch giảm = mCuCl2 + mCuO.
+ Đặt số mol 2 chất lần lượt là a và b ta có:
a + b = 0,15 mol (PT bảo toàn Cu).
135a + 80b = 14,75 (PT theo m dung dịch giảm).
+ Giải hệ ⇒ a = nCuCl2 = 0,05 mol ⇒ nNaCl = 0,05×2 = 0,1 mol.
⇒ CM NaCl = 0 , 1 0 , 2 = 0,5M
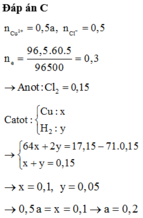



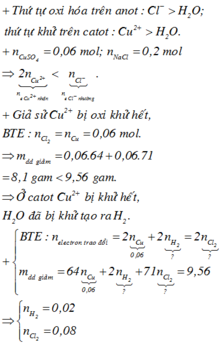
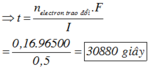
Chọn C
Ta có: