

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 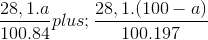 = 0,2
= 0,2
=> a = 29,89.

Chọn C
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+ chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu
0,36 ←0,18
2H2O + 2e → 2OH- + H2.
Anot: 2Cl- → Cl2 + 2e
2x x 2x
2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)

Chọn đáp án C.
Phương trình điện phân:
Catot: C u 2 + + 2 e → C u
![]()
![]()
· Điện phân t giây:
m C u = m c a t o t = 5 , 12 g
⇒ n C u 2 + p h ả n ứ n g = 0 , 08 m o l
· Điện phân 3t giây:
m C u = 11 , 52 g ⇒ n C u 2 + = 0 , 18 m o l
⇒ n H 2 = 2 . 3 . 0 , 08 - 2 . 0 , 18 2 = 0 , 06 m o l
⇒ n C l 2 + n O 2 = 6 , 272 22 , 4 - 0 , 06 = 0 , 22 m o l 2 n C l 2 + 4 n O 2 = 6 . 0 , 08 = 0 , 48 m o l
⇒ n C l 2 = 0 , 2 m o l n O 2 = 0 , 02 m o l
![]()

Đáp án A
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu Anot: 2Cl- → Cl2 + 2e
0,36 ←0,18 2x x 2x
2H2O + 2e → 2OH- + H2. 2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)

Đáp án B
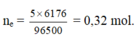
Fe + dung dịch sau điện phân → sinh khí NO
⇒ dung dịch sau điện phân chứa H+⇒ Cl– bị điện phân hết.
► Quy đổi sản phẩm điện phân về CuO và CuCl2 với số mol x và y.
ne = 2x + 2y = 0,32 mol; mdung dịch giảm = 80x + 135y = 15(g).
||⇒ giải hệ có: x = 0,12 mol; y = 0,04 mol ⇒ nKCl = nCl– = 2y = 0,08 mol.
⇒ nCu2+ = nCu(NO3)2 = 0,08 × 3 = 0,24 mol ⇒ nCu2+/dung dịch = 0,08 mol.
nO2 = 0,5x = 0,06 mol ⇒ nH+ = 0,06 × 4 = 0,24 mol.
► 4H+ + NO3– + 3e → NO + 2H2O || Cu2+ + 2e → Cu.
ne nhận tối đa = 3/4nH+ + 2nCu2+ = 0,34 mol < ne cho tối thiểu = 2nFe = 0,5 mol.
||⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2 ⇒ nFe phản ứng = 0,34 ÷ 2 = 0,17 mol.
► Hỗn hợp rắn gồm 0,08 mol Fe và 0,08 mol Cu ⇒ m = 9,6(g).

Đáp án B
ne = 5 x 6176 / 96500 = 0,32 mol. Fe+ dung dịch sau điện phân → sinh khí NO
⇒ dung dịch sau điện phân chứa H+ ⇒ Cl– bị điện phân hết.
► Quy đổi sản phẩm điện phân về CuO và CuCl2 với số mol x và y.
ne = 2x + 2y = 0,32 mol; mdung dịch giảm = 80x + 135y = 15(g).
⇒ giải hệ có: x = 0,12 mol; y = 0,04 mol ⇒ nKCl = nCl– = 2y = 0,08 mol.
⇒ nCu2+ = nCu(NO3)2 = 0,08 × 3 = 0,24 mol ⇒ nCu2+/dung dịch = 0,08 mol.
nO2 = 0,5x = 0,06 mol ⇒ nH+ = 0,06 × 4 = 0,24 mol.
► 4H+ + NO3– + 3e → NO + 2H2O
Cu2+ + 2e → Cu.
ne nhận tối đa = 3/4nH+ + 2nCu2+ = 0,34 mol < ne cho tối thiểu = 2nFe = 0,5 mol.
⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2 ⇒ nFe phản ứng = 0,34 ÷ 2 = 0,17 mol.
► Hỗn hợp rắn gồm 0,08 mol Fe và 0,08 mol Cu ⇒ m = 9,6(g)