
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(NaOH+HCl \to NaCl+H_2O\\ n_{NaOH}=0,06(mol)\\ \to n_{HCl}=0,06(mol)\\ V_{HCl}=\frac{0,06}{0,6}=0,1(l)=100(ml)\)

Gọi kim loại cần tìm là M và M cũng là khối lượng mol của nó
nH+ = 0,08 x 2 x 0,5 + 0,2 x 0,2 = 0,12 mol
nOH- = 0,2 x 0,1 = 0,02 mol
Xét phần dư của axit:
H+ + OH- = H2O
0,02_0,02_______(mol)
=> nH+ đã phản ứng với kim loại = 0,1 mol
2H+ + 2e = H2
0,1___0,1______(mol)
M = M2+ 2e
0,05____0,1_(mol)
M = 2,8 / 0,05 = 56 (Fe)
b) - Cho hỗn hợp qua dung dịch HCl dư, thu được phần không tan là SiO2
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Lọc dung dịch và lấy phần không tan cô cạn cho bay hết hơi H2O thu được SiO2
- dung dịch nước lọc gồm FeCl3, AlCl3, HCl
Cho NaOH dư vào dung dịch nước lọc, lọc kết tủa là Fe(OH)3, nung ngoài không khí đến khối lượng không đổi thu được Fe2O3
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
Al(OH)3 + NaOH = NaAlO2 + 2H2O
4Fe(OH)3 =to= 2Fe2O3 + 3H2O
- dung dịch còn lại lúc này là NaOH, NaAlO2
- Sục CO2 dư vào dung dịch, lọc lấy phẩn kết tủa là Al(OH)3, nung ngoài không khí đến khối lượng không đổi thu được Al2O3
NaAlO2 + CO2 + 2H2O = NaHCO3 + Al(OH)3
4Al(OH)3 =to= 2Al2O3 + 3H2O
cô chữa bài cho mình rồi, nó cứ kiểu gì ý??? đọc của bạn mình k hiểu j hết á?? bạn đọc thử bài cô chữa rồi dảng cho mình với

đọc bài của cô với bài của bạn mình rối não lắm, chẳng hiểu cái j hết ???

a) ta có : \(\dfrac{NaOH}{\dfrac{0,2}{\dfrac{0,2}{0}}}\dfrac{+}{ }\dfrac{H_2SO_4}{\dfrac{0,12}{\dfrac{0,1}{0,02}}}\dfrac{\rightarrow}{ }\dfrac{Na_2SO_4}{ }\dfrac{+}{ }\dfrac{2H_2O}{ }\)
\(\Rightarrow\dfrac{H_2SO_4}{0,02}\dfrac{\rightarrow}{ }\dfrac{2H^+}{0,04}\dfrac{+}{ }\dfrac{SO_4^{2-}}{ }\) \(\Rightarrow\left[H^+\right]=\dfrac{0,04}{0,4}=0,1\)
ta có : \(pH_B=-\log_{10}0,1=1\)
vậy \(pH\) của dung dịch \(B\) là \(1\)
b) ta có : \(\dfrac{NaOH}{0,2}\dfrac{\rightarrow}{ }\dfrac{Na^+}{ }\dfrac{+}{ }\dfrac{OH^-}{0,2}\)
\(\dfrac{H_2SO_4}{0,12}\dfrac{\rightarrow}{ }\dfrac{2H^+}{0,24}\dfrac{+}{ }\dfrac{SO_4^{2-}}{ }\)
\(\dfrac{Ba\left(OH\right)_2}{0,4}\dfrac{\rightarrow}{ }\dfrac{Ba^+}{ }\dfrac{+}{ }\dfrac{2OH^-}{0,8}\)
\(\Rightarrow\dfrac{H^+}{\dfrac{1}{\dfrac{0,24}{0,76}}}\dfrac{+}{ }\dfrac{OH^-}{\dfrac{0,24}{\dfrac{0,24}{0}}}\dfrac{\rightarrow}{ }\dfrac{H_2O}{ }\)
\(\Rightarrow CM_{OH^-}=\left[OH^-\right]=\dfrac{0,76}{0,6}\simeq1,267\left(M\right)\)
vậy .......................................................................................................

nOH- = 0,1+ 0,05.2=0,2(mol)
H+ + OH- -> H2O
=> nH+ = nOH- = 0,2(mol)
Mà: nH+ = 0,1.V+0,2.2.V
<=>0,2= 0,5.V
<=>V=0,4(l)=400(ml)

Đáp án B
nNaOH = 0,2 mol ; nBa(OH)2 = 0,05 mol; nOH-= 0,3 mol
nAl2(SO4)3 = 0,04 mol; nH2SO4 = 0,1.x mol; nH+ = 0,2x mol
H++ OH-→ H2O
0,2x 0,2x mol
Ba2+ + SO42- → BaSO4
0,05 0,12 0,05
Suy ra nAl(OH)3 = 0,06 mol < nAl3+ nên có 2 trường hợp xảy ra:
TH1: Kết tủa không bị hòa tan
Al3++ 3OH- → Al(OH)3
0,08 0,18← 0,06 mol
nOH- tổng = 0,22x+ 0,18 = 0,3 suy ra x = 0,6M
TH2: Kết tủa bị hòa tan 1 phần
Al3++ 3OH- → Al(OH)3
0,08 0,24 0,08
Al(OH)3+ OH- → AlO2-+ 2H2O
0,02 0,02
nOH- tổng = 0,2x+ 0,24+ 0,02 = 0,3 suy ra x = 0,2M

Ta thấy tỉ lệ số mol NaOH và số mol kết tủa không bằng nhau
Như vậy, phản ứng đầu chưa có kết tủa bị tan, ở phản ứng sau có kết tủa bị hòa tan
Phản ứng sau:
⇒
n
A
l
(
O
H
)
4
-
=
0
,
25
.
2
-
0
,
14
.
3
4
=
0
,
02
⇒
n
A
l
C
l
3
=
0
,
02
+
0
,
14
=
0
,
16
⇒
x
=
1
,
6
Đáp án A

Đáp án D
![]()
![]()
![]()
2NH3 + H2SO4® (NH4)2SO4
2NaOH + H2SO4® Na2SO4 + 2H2O
2 n H 2 S O 4 = n N A O H + n N H 3 ⇒ n N H 3 = 0 , 01 m o l
MX = 2,009.22,4 = 45 Þ n X = 0 , 45 45 = 0 , 01 m o l
Đặt CTPT của X là CxHyNz
Bảo toàn C: 0,01x = 0,02 Þ x = 2;
Bảo toàn N: 0,01z = 0,01 Þ z = 1
12.2 + y + 1.14 = 45 Þ y = 7 Þ CTPT là C2H7N

Chọn B
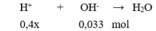
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có H + dư
→ 0,4x – 0,033 = 10 - 2 .0,3 → x = 0,09
\(n_{NaOH}=0,4\cdot0,1=0,04\left(mol\right)\\ PTHH:2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\\ \Rightarrow n_{H_2SO_4}=0,02\left(mol\right)\\ \Rightarrow x=C_{M_{H_2SO_4}}=\dfrac{0,02}{0,08}=0,25M\)