Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi x là số mol CuO tham gia pư
ylà số mol CuO dư
CuO+H2----->Cu+H2O
x x x
Ta có hệ PT:
(x+y)80=28
64x+80y=24
\(\Rightarrow\) x=0,25;y=0,1
mH2O=0,25*18=4,5g

Chú ý: H2, CO chỉ khử được oxit kim loại trung bình và yếu (không khử được oxit của Na, K, Ca, Ba, Mg, Al)
Ống (1): không xảy ra phản ứng
Ống (2): CuO + H2 → Cu + H2O↑
1 → 1
Ống (3): Fe2O3 + 3H2 → 2Fe + 3H2O↑
1 → 3
Hỗn hợp khí đi ra khỏi ống (3) gồm: H2 dư và 4 mol hơi H2O
Ống (4): C + 2H2O → CO2 + 2H2↑
1→ 2 1 2
Dư: 2
Hỗn hợp khí đi ra khỏi ống (4) gồm: 2 mol H2O; 1 mol CO2; H2 dư
Ống (5): Na2O + H2O → 2NaOH
1 → 1 2
CO2 + 2NaOH → Na2CO3 + H2O
1 → 2 1

a)
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
Gọi số mol CuO bị khử là a
\(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
a----------------->a
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
a---------------------------->a
=> a = 0,15 (mol)
=> Phần trăm CuO bị khử = \(\dfrac{0,15}{0,2}.100\%=75\%\)
b)
Bảo toàn Cu: \(n_{CuSO_4}=n_{CuO}=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{BaSO_4}=0,2\left(mol\right)\\n_{CuO}=0,2\left(mol\right)\end{matrix}\right.\)
=> mrắn = 0,2.233 + 0,2.80 = 62,6(g)

PTHH: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
a) Hiện tượng: Xuất hiện chất rắn màu đỏ
b) Ta có: \(n_{CuO}=\frac{20}{80}=0,25\left(mol\right)\) \(\Rightarrow n_{Cu}=0,25mol\) \(\Rightarrow m_{Cu}=0,25\cdot64=16\left(g\right)\)
\(\Rightarrow H\%=\frac{16}{16,8}\cdot100\approx95,24\%\)
c) Theo PTHH: \(n_{H_2}=n_{CuO}=0,25mol\)
\(\Rightarrow V_{H_2}=0,25\cdot22,4=5,6\left(l\right)\)

CuO + H2 → Cu + H2O (1)
CuO + CO → Cu + H2O (2)
nhh khí = 0,05 (mol)
Theo PTHH (1) và (2) ta có:
nCu = nhh khí = 0,05 (mol)
nCu = 64.0,05 = 3,2 (g)

nCuO=0,02 mol
CuO+H2=>H2O+Cu
Bđ0,02 mol
Pứ:x mol =>x mol
Dư:0,02-x mol
Cr sau pứ gồm Cu và CuO
=>64(0,02-x)+80x=1,344
=>16x=0,064=>x=0,004
H%=0,004/0,02.100%=20%

Như vậy khi phản ứng Cu xảy ra hoàn toàn thì khối lượng tăng lên 1/4
Theo đề bài, sau phản ứng khối lượng chất rắng
Cu tăng lên 1/6 khối lượng bạn đầu => Cu chưa bị oxi hóa hết thu được CuO và Cu còn dư
Giả sử thí nghiệm với 128 Cu. Theo đề, g oxi phản ứng:
128/6 = 21,333 g
Theo PTHH của phản ứng số g Cu đã phản ứng với số g oxi và số g CuO được tạo thành:
128.32 . 21,333 = 85,332 g ; mCuO = 160/32 21,333 = 106,665 g
Số g Cu còn lại :
128 - 85,332 = 42,668 g
%Cu = \(\frac{42,668}{149,333}100=28,57\%\) => %CuO = 71,43%
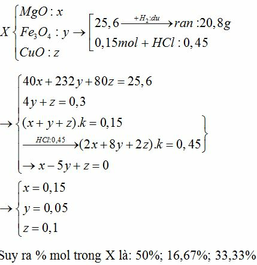
Gọi x là số mol CuO tham gia pư
ylà số mol CuO dư
CuO+H2----->Cu+H2O
Ta có hệ PT:
(x+y)80=28
64x+80y=24
⇒⇒ x=0,25;y=0,1
mH2O=0,25*18=4,5g
Đề bài yêu cầu là tìm \(H\) phản ứng chứ ko phải là \(m_{hơi.nước}\)