Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
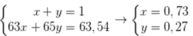
Phần trăm khối lượng của 63Cu trong CuSO4 là
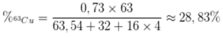

Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
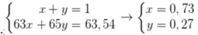
Phần trăm khối lượng của 63Cu trong Cu2O là
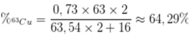

`a)`
\(\%m_{^{65}Cu}=100-73=27\%\)
`->M_{Cu}={63.73+65.27}/{100}=63,54(g//mol)`
`n_{Cu_2O}={7,154}/{63,54.2+16}=0,05(mol)`
`->n_{Cu}=0,1(mol)`
\(\to m_{^{63}Cu}=0,1.63,54.73\%=4,63842(g)\)
`b)`
`\%m_{Cu}={63,54}/{63,54+32+16.4}.100\%\approx 39,827\%`

\(\overline{NTK}_{Cu}=63,54\\ \Leftrightarrow\dfrac{63.x+65.\left(100\%-x\right)}{100\%}=63,54\\ \Leftrightarrow x=73\%\\ \Rightarrow\%m_{\dfrac{^{63}Cu}{CuCl_2}}=73\%.\dfrac{63,54}{63,54+35,5.2}.100\approx34,476\%\)

Đáp án D.
Nguyên tử khối trung bình của Cu:

2 mol Cu = 63,5.2=127 gam

Đáp án D
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt
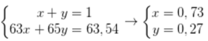
Phần trăm khối lượng của 63Cu trong CuCl2 là
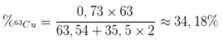
sai r kìa bạn, M(CuSO4)= 63,54+ 32+16*3=143.54(dvC)
À mình biết sai chỗ nào rồi! Nhưng bạn cũng sai mà. \(M_{CuSO_4}=63,54+32+16\cdot4=159,54\)(g/mol)