Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dùng Ba(OH)2
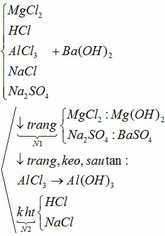
Lấy ngẫu nhiên 1 lọ thuộc nhóm (2) nhỏ vào kết tủa của nhóm (1). Có 2 TH xảy ra:
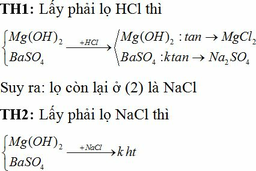
Suy ra: lọ lấy ở (2) là NaCl → lọ còn lại ở (2) là HCl. Dùng HCl nhận biết MgCl2 và Na2SO4 dựa vào kết tủa của chúng như TH1.
Pt: MgCl2 + Ba(OH)2 → BaCl2 + Mg(OH)2↓
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4↓
2HCl + Ba(OH)2 → BaCl2 + 2H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O

Câu 13 mình vừa trả lời rồi nhé.
Câu 14:
a, \(SO_3+H_2O\rightarrow H_2SO_4\)
b, \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
c, \(CaO+2HCl\rightarrow CaCl_2+H_2O\)
d, \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
e, \(SO_2+H_2O⇌H_2SO_3\)
g, \(Fe\left(OH\right)_2\xrightarrow[kckk]{t^o}FeO+H_2O\)
h, \(MgO+2HCl\rightarrow MgCl_2+H_2O\)
f, \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
Câu 15:
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
PT: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
a, \(n_{H_2}=n_{Mg}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.24,79=2,479\left(l\right)\)
b, \(n_{H_2SO_4}=n_{Mg}=0,1\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{0,1}=1\left(M\right)\)
c, \(m_{ddH_2SO_4}=\dfrac{0,1.98}{20\%}=49\left(g\right)\Rightarrow V_{ddH_2SO_4}=\dfrac{49}{1,14}\approx42,98\left(ml\right)\)

- Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa xanh: NaOH
+ Quỳ hóa đỏ: HCl
+ Quỳ không đổi màu: NaCl, Na2SO4 (1)
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: Na2SO4
PT: \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_4\)
+ Không hiện tượng: NaCl
- Dán nhãn.

a. - Trích mẫu thử: Lấy ở mỗi lọ một lượng nhỏ ra ống nghiệm để nhận biết.
- Lấy dung dịch Na2CO3 cho vào mỗi ống trên:
+ Xuất hiện kết tủa trắng \(\Rightarrow\) Nhận biết được BaCl2.
BaCl2 + Na2CO3 \(\rightarrow\) BaCO3 \(\downarrow\)+ 2NaCl.
+ Có khí bay lên Þ Nhận biết được HCl:
2HCl + Na2CO3 \(\Rightarrow\) 2NaCl + CO2 + H2O.
+ Hai ống nghiệm không có hiện tượng gì chứa NaCl và Na2SO4.
- Dùng BaCl2 vừa nhận biết được ở trên cho vào hai mẫu chứa NaCl và Na2SO4:
+ Xuất hiện kết tủa trắng \(\Rightarrow\) Nhận biết được Na2SO4.
Na2SO4 + BaCl2 \(\rightarrow\) BaSO4\(\downarrow\) + 2NaCl.
+ Còn lại là NaCl.
b. Khi sục khí cacbonic vào dung dịch Ba(OH)2 đến dư, ban đầu xuất hiện kết tủa trắng, sau tan dần.
CO2 + Ba(OH)2 \(\rightarrow\) BaCO3\(\downarrow\) + H2O
CO2 + BaCO3 + H2O \(\rightarrow\) Ba(HCO3)2.
* Cho từ từ dung dịch HCl đến dư vào dung dịch NaOH loãng có chứa một lượng nhỏ phenolphtalein: dung dịch có màu hồng, sau nhạt dần đến mất hẳn.
HCl + NaOH \(\rightarrow\) NaCl + H2O.

- Lấy mỗi chất 1 ít cho vào giấy quỳ tím vào từng mẫu thử
+ Nếu hóa đỏ \(\rightarrow HCl\)
+ Nếu không màu \(\rightarrow Na_2SO_4,KNO_3\)
- Lấy 2 dd Na2SO4, KNO3 cho vào dd BaCl2 vào từng mẫu thử
+ Nếu có phản ứng \(\downarrow\rightarrow Na_2SO_4\)
\(PTHH:Na_2SO_4+BaCl_2\rightarrow BaSO_4+2NaCl\)
+ Nếu không phản ứng \(\downarrow\rightarrow KNO_3\)

- Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa xanh: KOH
+ Quỳ hóa đỏ: HNO3
+ Quỳ không đổi màu: Na2SO4, NaCl (1)
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: Na2SO4
PT: \(Na_2SO_4+BaCl_2\rightarrow2NaCl+BaSO_{4\downarrow}\)
+ Không hiện tượng: NaCl.
- Dán nhãn.

Câu 1:
Gọi số mol của Mg, Fe lần lượt là a, b (mol)
PTHH:
Mg + 2HCl ===> MgCl2 + H2
a.............................................a
Fe + 2HCl ===> FeCl2 + H2
b...........................................b
nH2 = 11,2 / 22,4 = 0,5 (mol)
Lập các số mol trên phương trình, ta có:
\(\begin{cases}24x+56y=23,2\\x+y=0,5\end{cases}\)
\(\Rightarrow\begin{cases}x=0,15\\y=0,35\end{cases}\)
=> mMg = 0,15 x 24 = 3,6 gam
mFe = 0,35 x 56 = 19,6 gam

| \(Na_2SO_4\) | \(NaCl\) | \(H_2SO_4\) | |
| Quỳ tím | _ | _ | Đỏ |
| \(AgNO_3\) | _ | ↓Trắng | ↓Ít tan |
\(AgNO_3+NaCl\rightarrow AgCl+NaNO_3\)
\(2AgNO_3+H_2SO_4\rightarrow Ag_2SO_4+2HNO_3\)

Lấy mỗi chất một ít làm thí nghiêm.
- Nhúng quỳ vào từng mẫu thử:
+ quỳ chuyển xanh: KOH
+ quỳ không chuyển màu: \(KCl,Na_2SO_4,NaNO_3\)
- Dùng dung dịch \(AgNO_3\) lấy dư cho vào các mẫu thử không làm quỳ chuyển màu.
+ Kết tủa trắng: KCl
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\)
+ Có kết tủa trắng có hiện tượng ít tan: \(Na_2SO_4\)
\(Na_2SO_4+2AgNO_3\rightarrow Ag_2SO_4+2NaNO_3\)
+ Không hiện tượng: NaNO3
Cho thử quỳ tím:
- Chuyển đỏ -> HCl
- Không đổi màu -> Na2SO4, NaHSO4, NaCl (1)
Cho các chất (1) tác dụng với BaCl2 và nhúng quỳ tím:
- Xuất hiện kết tủa trắng và không làm quỳ tím đổi màu -> Na2SO4
Na2SO4 + BaCl2 -> 2NaCl + BaSO4
- Xuất hiện kết tủa trắng và làm quỳ tím chuyển đỏ
2NaHSO4 + BaCl2 -> BaSO4 + Na2SO4 + 2HCl
- Không hiện tượng -> NaCl