

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
Bảo toàn điện tích suy ra x = 0,025 mol
Ba2++ SO42-→BaSO4
0,03 0,025 0,025
OH-+ NH+4→ NH3+ H2O
0,06 0,05
Dung dịch Y có 0,12 mol Na+; 0,12 mol Cl-; 0,005 mol Ba2+; OH- 0,01 mol
Khi cô cạn thu được m = 0,12.23+ 0,12.35,5+ 0,005.137+ 0,01.17 = 7,875 gam

Đáp án C
Bảo toàn điện tích: 2x = 0,05 + 0,12 – 0,12 ⇒ x = 0,025
Ba2+ + SO42- → BaSO4
0,025 ← 0,025 → 0,025 (mol)
NH4+ + OH- → NH3 + H2O
0,05 → 0,05 → 0,05 0,05 ( mol)
mchất rắn = mX + mBa(OH)2 – mBaSO4 – mNH3 – mH2O = 7,875g

Đáp án C
Bảo toàn điện tích:
0,12.1 + 0,05.1 = 0,12.1 + 2x
Þ x = 0,025
![]()
![]()
![]()
![]()
![]()
![]()
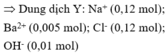
m = 0,12.23 + 0,005.137 + 0,12.35,5 + 0,01.17 = 7,875 (gam)

Đáp án B
Theo ĐLBT ĐT thì: 0,01.2+ b = 0,01+a
H+ + OH- → H2O
nOH-= nH+= 0,04 mol = a suy ra b = 0,03 mol
Khối lượng chất rắn thu được khi cô cạn dung dịch X là:
0,01.137+ 0,01.62+ 17.0,04+ 23.0,03 = 3,36 gam

\(n_{NH_4^+}=x;n_{SO_4^{2-}}=y\\ x-2y=0,2-0,2=0\\ NH_4^++OH^-->NH_3+H_2O\\ x=\dfrac{4,48}{22,4}=0,2\\ y=0,1\\ a.m_{ }=18x+0,1.56+0,2.62+96y=31,2g\\ b.n_{Ba\left(OH\right)_2}=0,15.1=0,15mol\\ n_{OH^-}=0,3mol\\ m=0,1.233+0,1.90=32,3g\)