Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

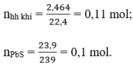
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

a)Fe + 2HCl ->FeCl2 + H2\(\uparrow\)
0.01 0.01
FeS + 2HCl ->FeCl2 + H2S\(\uparrow\)
0.1 0.1
H2S + Pb(NO3)2->PbS \(\downarrow\) + 2HNO3
0.1 0.1
nPbS =2.39/239=0.1 mol , n (hỗn hợp khí) =2.464/22.4=0.11 mol
n(H2)+n(H2S)=0.11 ->n(H2)=0.01 mol
V(H2)=n * 22.4 = 0.01*22.4=0.224(l)
V(H2S)=n*22.4=0.1*22.4=2.24(l)
m(Fe)=n*M=0.01*56=0.56(g)
m(FeS)=n*M=0.1*88=8.8(g)

Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
- Nếu Zn tan hết
2Na + 2H2O --> 2NaOH + H2
a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
2b<----b-------------------->b
->\(\left\{{}\begin{matrix}2b\text{≤}a\\0,5a+b=14,3\end{matrix}\right.\) loại
=> Zn không tan hết => NaOH hết
PT:2Na + 2H2O --> 2NaOH + H2
a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
\ a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
PTP. ứng:
Fe+S----> FeS
Fe+ 2HCl--> FeCl2+H2
x x (mol)
FeS+ 2HCl--> FeCl2+ H2S
y y (mol)
Gọi n H2 và H2S trong C lần lượt là x và y mol, ta có hpt:
x+y=0.1
(2x+32y)/2(x+y)=13
--> x=0.02, y=0.08
--> tổng m Fe+n FeS= n Fe tỏng A=x+y=0.1 mol
m Fe=0.1.56=5.6 (g)

$SO_2 + Br_2 + 2H_2O \to 2HBr + H_2SO_4$
n SO2 = n Bt2 = 272/160 = 1,7(mol)
=> n CO2 = 44,8/22,4 - 1,7 = 0,3(mol)
Bảo toàn nguyên tố C :
n FeCO3 = n CO2 = 0,3(mol)
n FeS2 = a(mol) ; n Fe3O4 = b(mol)
0,3.116 + 120a + 232b = 82(1)
Bảo toàn e :
0,3 + 15a + b = 2n SO2 = 1,7.2(2)
Từ (1)(2) => a = 0,2 ; b = 0,1
n Fe3O4 = 0,1(mol)

\(n_{H2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
a 0,4 0,2 1a
\(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
b 0,3 0,15 1b
a) Gọi a là số mol của Mg
b là số mol của Fe
\(m_{Mg}+m_{Fe}=13,2\left(g\right)\)
⇒ \(n_{Mg}.M_{Mg}+n_{Fe}.M_{Fe}=13,2g\)
⇒ 24a + 56b = 13,2g (1)
Theo phương trình : 1a + 1b = 0,35(2)
Từ(1),(2), ta có hệ phương trình :
24a + 56b = 13,2g
1a + 1b = 0,35
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,15\end{matrix}\right.\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
0/0Mg = \(\dfrac{4,8.100}{13,2}=36,36\)0/0
0/0Fe = \(\dfrac{8,4.100}{13,2}=63,64\)0/0
b) \(n_{HCl\left(tổng\right)}=0,4+0,3=0,7\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddHCl}}=\dfrac{0,7}{0,2}=3,5\left(M\right)\)
c) \(m_{muối.clorua}=\left(0,2.95\right)+\left(0,15.127\right)=38,05\left(g\right)\)
Chúc bạn học tốt

\(a,Fe+2HCl\rightarrow FeCl_2+H_2\\ CuO+2HCl\rightarrow CuCl_2+H_2O\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow n_{Fe}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow\%m_{Fe}=\dfrac{0,1.56}{13,6}.100\%\approx41,176\%\\ \Rightarrow\%m_{CuO}\approx58,824\%\\ b,n_{CuO}=\dfrac{13,6-0,1.56}{80}=0,1\left(mol\right)\\ n_{HCl\left(p.ứ\right)}=2.\left(n_{Fe}+n_{CuO}\right)=2.\left(0,1+0,1\right)=0,4\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,4}{2}=0,2\left(l\right)\)

a) \(n_{PbS}=\dfrac{23,9}{239}=0,1\left(mol\right)\)
=> \(n_{H_2S}=0,1\left(mol\right)\)
\(\%V_{H_2S}=\dfrac{0,1.22,4}{2,464}.100\%=90,9\%\)
\(\%V_{H_2}=100\%-90,9\%=9,1\%\)
b) \(n_{H_2}=\dfrac{2,464.9,1\%}{22,4}=0,01\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,01<-------------------0,01
FeS + 2HCl --> FeCl2 + H2S
0,1<---------------------0,1
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,01.56}{0,01.56+0,1.88}.100\%=5,983\%\\\%m_{FeS}=\dfrac{0,1.88}{0,01.56+0,1.88}.100\%=94,017\%\end{matrix}\right.\)


a,
\(C_2H_2+2AgBr_2+2NH_3\rightarrow Ag_2C_2+2NH_4NO_3\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\left(1\right)\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\left(2\right)\)
b,Ta có :
\(n_{C2H2}=n_{Ag2C2}=\frac{16,8}{240}=0,07\left(mol\right)\)
\(n_{Br2\left(2\right)}=2n_{C2H2}=0,14\left(mol\right)\)
\(\Rightarrow\Sigma n_{Br2}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow n_{Br2\left(1\right)}=0,2-0,14=0,06\left(mol\right)\)
\(\Rightarrow n_{C2H4}=0,06\left(mol\right)\)
\(\Rightarrow\%_{C2H2}=\frac{0,07}{0,13}.100\%=53,85\%\)
\(\Rightarrow\%_{C2H4}=100\%-53,85\%=46,15\%\)