Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Al + 6HCl → 2AlCl3 + 3H2
a) Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}\times0,2=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3\times22,4=6,72\left(l\right)\)
b) Theo PT: \(n_{Al}pư=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}\times0,15=0,1\left(mol\right)\)
\(\Rightarrow H=\dfrac{n_{Al}pư}{n_{Al}}\times100\%=\dfrac{0,1}{0,2}\times100\%=50\%\)

\(m_{\text{dung dịch sau phản ứng}}=m_{Al\left(pư\right)}+m_{dd_{H_2SO_4}}-m_{H_2}\)
Khối lượng Al là khối lượng dư sau phản ứng chứ sao tính bằng H2SO4 được em.
Maximilian Anh ơi tính cái dư hay là cái hết ạ phải tính khói lượng AL dư hay là tính khối lượng AL dựa vào H2SO4 ạ

LTL: 0,2/2 > 0,4/6 => Al dư
nH2 = 0,6/2 = 0,3 (mol)
VH2 = 0,3 . 22,4 = 3,36 (l)
=> A

a) \(m_X=0,1\cdot64+0,2\cdot27+0,3\cdot24=19\left(g\right)\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,1\cdot64\cdot100}{19}=34\%\)
\(\Rightarrow\%m_{Al}=\dfrac{0,2\cdot27\cdot100}{19}=28\%\)
\(\Rightarrow\%m_{Mg}=100\%-34\%-28\%=38\%\)
b) \(Cu+2HCl\rightarrow CuCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
\(Mg+2HCl\rightarrow MgCl_2+H_2\) (3)
\(n_{HCl\left(1\right)}=2n_{Cu}=2\cdot0,1=0,2\left(mol\right)\)
\(n_{HCl\left(2\right)}=\dfrac{6\cdot n_{Al}}{2}=3\cdot0,2=0,6\left(mol\right)\)
\(n_{HCl\left(3\right)}=2n_{Mg}=2\cdot0,3=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=\left(0,2+0,6+0,6\right)\cdot36,5=51,1\left(g\right)\)
\(n_{H_2\left(1\right)}=n_{Cu}=0,1\left(mol\right);n_{H_2\left(2\right)}=\dfrac{3\cdot0,2}{2}=0,3\left(mol\right);n_{H_2\left(3\right)}=n_{Mg}=0,3\left(mol\right)\)
\(V_{H_2\left(dkc\right)}=\left(0,1+0,3+0,3\right)\cdot24,79=17,353\left(l\right)\)

Câu 7 :
1) \(n_{Fe3O4}=\dfrac{34,8}{232}=0,15\left(mol\right)\)
Pt : \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O|\)
1 4 3 4
0,15 0,45
\(n_{Fe}=\dfrac{0,15.3}{1}=0,45\left(mol\right)\)
\(m_{Fe\left(Lt\right)}=0,45.56=25,2\left(g\right)\)
⇒ \(m_{Fe\left(tt\right)}=25,2.90\%=22,68\left(g\right)\)
Chúc bạn học tốt
\(n_{Fe_3O_4}=\dfrac{34,8}{232}=0,15\left(mol\right)\)
\(pthh:Fe_3O_4+H_2\underrightarrow{t^o}Fe+H_2O\)
0,15 0,15
=> \(m_{Fe}=\dfrac{90.0,15}{100}.56=7,56\left(g\right)\)

ta có nCO2=\(\frac{13.44}{22.4}\)=0,6 mol
bt1) Fe2O3+ CO\(\rightarrow\) CO2+Fe
ta có nFe= 0,6 mol
vậy mFe=0,6.56=33,6
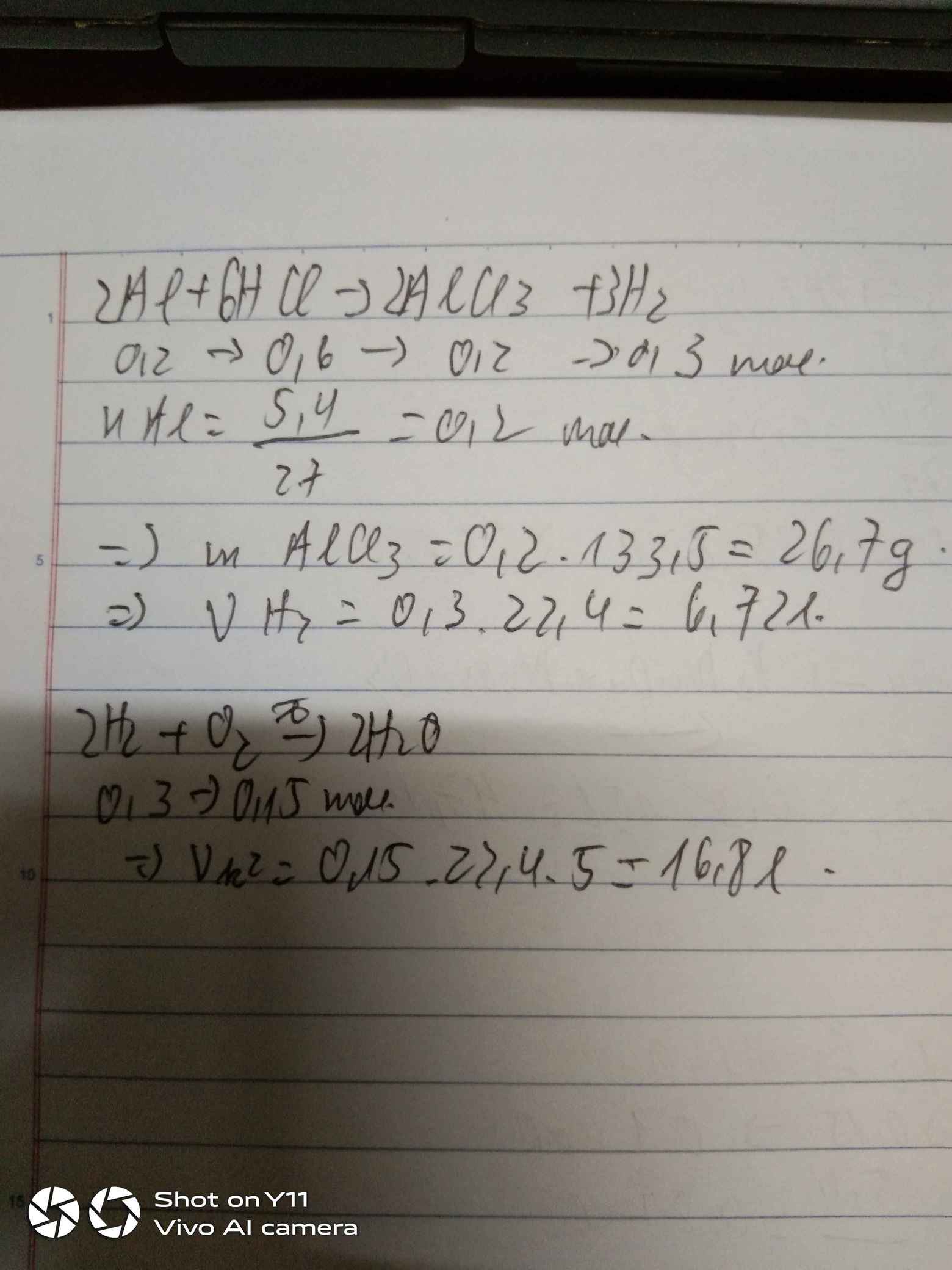
2Al + 6HCl → 2AlCl3 + 3H2
a) Theo PT: \(n_{H_2}lt=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}\times0,1=0,15\left(mol\right)\)
Do \(H\%=80\%\Rightarrow n_{H_2}tt=0,15\times80\%=0,12\left(mol\right)\)
\(\Rightarrow V_{H_2}tt=0,12\times22,4=2,688\left(l\right)\)
b) Theo PT: \(n_{HCl}=3n_{Al}=3\times0,1=0,3\left(mol\right)\)
Do \(H\%=90\%\Rightarrow n_{HCl}pư=0,3\times90\%=0,27\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,27\times36,5=9,855\left(g\right)\)
Thực thu