Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Công thức tính tốc độ tức thời của phản ứng là: v1 = k.CNO2.CO2
b)
- Nồng độ O2 tăng 3 lần, nồng độ NO không đổi: v2 = k.CNO2.(CO2.3)
=> v2 tăng 3 lần so với v1
- Nồng độ NO tăng 3 lần, nồng độ O2 không đổi: v3 = k.(CNO.3)2.CO2 = k.CNO2.9.CO2
=> v3 tăng 9 lần so với v1
- Nồng độ NO và O2 đều tăng 3 lần: v4 = k.(CNO.3)2.(CO2.3) = k.CNO2.27.CO2
=> v4 tăng 27 lần so với v1

Câu 21, 23: Em thay dữ kiện vào công thức:
\(ln\frac{k_1}{k_2}=\frac{-E_a}{R}.\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\)
Câu 22: không đổi do tốc độ pứ hệ không phụ thuộc vào thể tích hỗn hợp.

(a) v tăng lên 83 lần
(b) v tăng lên 23 = 8 lần
(c) v tăng lên 4.22 = 16 lần
(d) v tăng lên 42/2 = 8 lần
Đáp án B

Tốc độ tức thời của phản ứng:
\(v=k\left[NO\right]^2.\left[O_2\right]\)
a,
Khi tăng nồng độ NO lên gấp đôi:
\(v=k\left(2\left[NO\right]\right)^2.\left[O_2\right]=4k\left[NO\right]^2.\left[O_2\right]\)
Vậy tốc độ tăng gấp 4 lần
b,
Khi thể tích giảm 1 nửa, nồng độ mỗi chất tăng gấp đôi:
\(v=k\left(2\left[NO\right]\right)^2.2\left[O_2\right]=8k\left[NO\right]^2.\left[O_2\right]\)
Vậy tốc độ tăng gấp 8 lần
c,
Độ tăng nhiệt:
\(\Delta t^o=1900-400=1500\)
Với mỗi lần tăng nhiệt độ 150oC, tốc độ tăng 3 lần.
Vậy khi tăng nhiệt độ 10 lần như vậy, tốc độ tăng 310 = 59049 lần

Áp suất tăng 2 lần thì thể tích giảm 2 lần nên nồng độ tăng 2 lần và phản ứng xảy ra chiều thuận. Do đó tốc độ phản ứng sẽ tăng 2.2 = 4 lần.
Áp suất tăng 2 lần thì thể tích giảm 2 lần nên nồng độ tăng 2 lần và phản ứng xảy ra chiều thuận. Do đó tốc độ phản ứng sẽ tăng 2.2 = 4 lần.
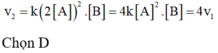

Áp suất tăng 3 lần, nhiệt độ không đổi thì thể tích giảm 3 lần nên nồng độ tăng 3 lần
Vậy tốc độ phản ứng tăng: 3.3.3 = 27 (lần)