Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nHNO3 = 0,72 mol ; nNaOH = 0,3 mol ; nKOH = 0,15 mol
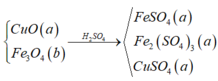
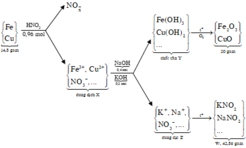
Đặt nFe = x ; nCu = y => nFe2O3 = 0,5x ; nCuO = y
Ta có : 56x + 64y = 11,1g ; 80x + 80y = 15
=> x = 0,1125 ; y = 0,075
Giả sử chất rắn khan sau khi nung T gồm 0,3 mol NaNO2 và 0,15 mol KNO2
mT = 0,3.69 + 0,15.85 = 33,45g > 322,145g => trong chất rắn khan sau nung T có cả bazo dư
Đặt nNO2 = a ; nOH = b
0,3.23 + 0,15.39 + 46a + 17b = 32,145
a + b = 0,45
=> a = 0,405 ; b = 0,045
Do nNO3 muối = 0,405 < 3nFe + 2nCu = 3.0,1125 + 2.0,075 = 0,4875
=> Sản phẩm có cả Fe2+ và Fe3+ và HNO3 phản ứng hết.
Trong dung dịch X có : z mol Fe2+ ; t mol Fe3+ ; 0,075 mol Cu2+ ; 0,405 mol NO3-
Bảo toàn Fe : z + t = 0,1125
Bảo toàn điện tích : 2z + 3t + 2.0,075 = 0,405
=> z = 0,0825 và t = 0,03
Bảo toàn H : nH2O = ½ nHNO3 = 0,36 mol
Bảo toàn khối lượng : msp khử = mHNO3 – mNO3 muối – mNO3 (X) – mH2O = 13,77g
mdd X = mKL + mdd HNO3 – msp khử = 91,83g
=> C% Fe(NO3)3 = 7,91%
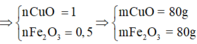
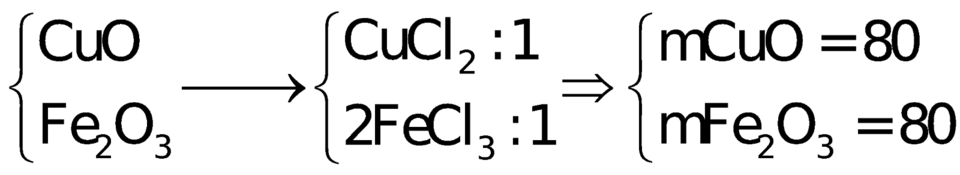
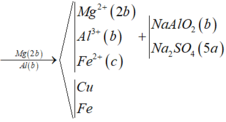
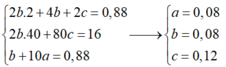
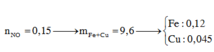
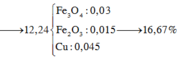
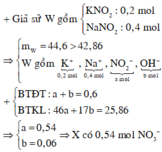
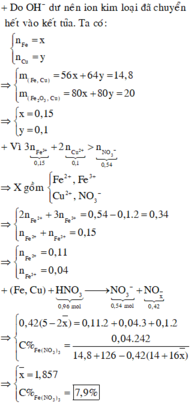
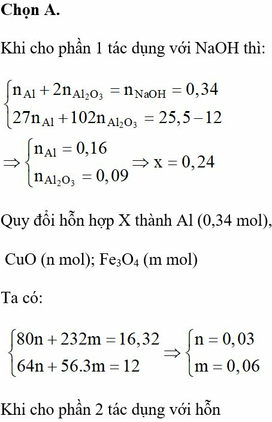

Đáp án B
Giả sử nCuCl2 = nFeCl3 = 1
=>