Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài này ta có thể chia làm 2 trường hợp
TH1 sau pư Mg còn dư. Chỉ có phản ứng (1) khối lượng chất rắn thu được là
Fe vào Mg dư
nFe = nFeCl3 = 0,12 mol => mFe = 0,12*56 = 6,72g > 3,36 (loại)
TH2 Xẩy ra 2 phản ứng (1) và (2) ( khi Mg hết FeCl3 còn sẽ tác dụng tiếp với Fe)
3Mg + 2FeCl3 ---> 3MgCl2 + 2Fe (1)
a --------->2a/3 ----------------> 2a/3
Fe + 2FeCl3 --> 3FeCl2 (2)
2a/3-0,06 --> 2(2a/3 - 0,06)
đặt nMg = a mol
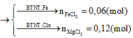
nFe dư sau pư 2 = 3,36:56 = 0,06 mol
=> nFe (pư2) = (2a/3 - 0,06) mol
theo pư 1, 2 nFeCl3 = 2a/3 + 2(2a/3 - 0,06) = 0,12 mol
=> a = 0,12 mol
=> m = 0,12*24 = 2,88 g
=> Đáp án B

Chọn đáp án B.
0,08×3 < nFe3+ + 2nCu2+ => Lượng Al đề cho chỉ đủ để khử 1 phần Cu2+ ra khỏi dung dịch
BTE => 0,08×3 = 0,06 + 2nCu => nCu = 0,09
Vậy mX = 0,09×64 =5,76 gam

n Mg = 0,25 mol.
Phản ứng : Mg + 2FeCl3 → 2FeCl2 + MgCl2
Mg + CuCl2 → MgCl2 + Cu
Mg + FeCl2 → Fe + MgCl2
=> Sau phản ứng tạo 0,12 mol Cu và 0,02 mol Fe
=> m A = 8,8g
=>D

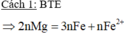
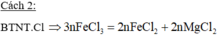
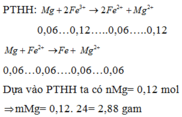


Đáp án D