Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án A
nMg = 0,2 mol
nFeSO4 = 0,1 mol và nCuSO4 = 0,15 mol
PTHH : Mg + CuSO4 → MgSO4 + Cu
→ sau phản ứng này Mg dư 0,05 mol và tạo ra 0,15 mol Cu
Mg + FeSO4 → MgSO4 + Fe
→ thu được 0,05 mol Fe
→m = 0,15.64 + 0,05.56 =12,4 g

Đáp án C.
![]()
Mg phản ứng trước với Cu(NO3)2 sau đó phản ứng với Fe(NO3)2.
Giả sử Mg phản ứng vừa đủ với Cu(NO3)2, khi đó:
mrắn = mCu = 0,1.64 = 6,4 gam < 9,2 gam
Giả sử Mg phản ứng vừa đủ với 2 dd trên, khi đó:
mrắn = mCu + mFe =0,1.56 + 0,1.64 = 12 gam > 9,2 gam
→ Cu(NO3)2 phản ứng hết, Fe(NO3)2 phản ứng một phần.
mFe = 9,2 – 6,4 = 2,8 gam
à nFe =nFe(NO3)2 = 2,8 : 56 = 0,05 mol.
Bảo toàn e: nMg.2 = 0,05.2 + 0,1.2 ↔ nMg = 0,15 mol → mmg = 0,15.24 = 3,6 gam.

Đáp án D
Trong phản ứng của Fe với dung dịch X, chất khử là Fe, chất oxi hóa là NO 3 - / H + , Fe3+ và Cu2+. Sau phản ứng thu được hỗn hợp kim loại, chứng tỏ Fe dư nên muối tạo thành trong dung dịch là Fe2+.
Áp dụng bảo toàn electron trong phản ứng của Fe với dung dịch X, bảo toàn điện tích trong dung dịch Y và bảo toàn nguyên tố Fe, N, ta có :
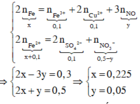
Theo bảo toàn khối lượng, ta có :



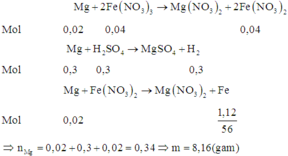

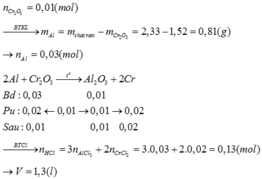
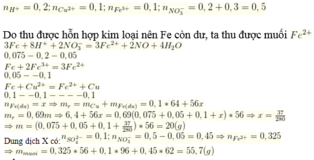
Đáp án D