Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sau phản ứng thu được 2 kim loại là Ag và Cu => Mg và Al phản ứng hết.
Đặt số mol Cu2+ phản ứng là x
=> m + 57,8 = 108.0,5 + 64x
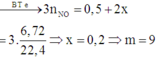
=> Chọn đáp án A

B gồm 3 kim loại là Fe, Cu, Ag
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,03<----------------0,03
Gọi số mol Cu, Ag là a, b (mol)
=> 64a + 108b = 8,12 - 0,03.56 = 6,44 (g) (1)
\(\left\{{}\begin{matrix}n_{Al^{3+}}=\dfrac{0,81}{27}=0,03\left(mol\right)\\n_{Fe^{2+}}=\dfrac{2,8}{56}-0,03=0,02\left(mol\right)\end{matrix}\right.\)
=> \(n_{NO_3^-}=0,03.3+0,02.2=0,13\left(mol\right)\)
\(\left\{{}\begin{matrix}n_{Cu\left(NO_3\right)_2}=a\left(mol\right)\\n_{AgNO_3}=b\left(mol\right)\end{matrix}\right.\)
=> 2a + b = 0,13 (2)
(1)(2) => a = 0,05 (mol); b = 0,03 (mol)
=> \(C_{M\left(Cu\left(NO_3\right)_2\right)}=\dfrac{0,05}{0,1}=0,5M\)

Đáp án A
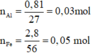
Sau phản ứng thu được 3 kim loại => Fe còn dư; Al, AgNO3 và Cu(NO3)2 đều phản ứng hết; 3 kim loại thu được gồm Ag, Cu và Fe dư.
![]()
Đặt số mol của AgNO3 và Cu(NO3)2 lần lượt là a, b
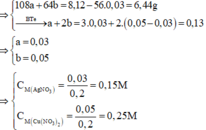

Do Cu dư sau pư⟶hỗn hợp Y chứa muối Fe2+
nCu trong X = 0,1; nAgCl = 0,6
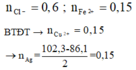
BTKL ⟶ m = 29,2
Đáp án C

Đáp án C
Do kim loại Cu dư nên dung dịch Y không thể có Fe3+
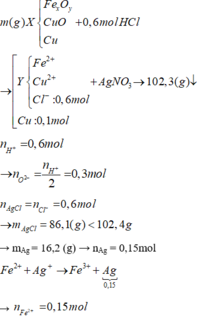
Áp dụng định luật bảo toàn điện tích trong dung dịch Y → nCu2+ = 0,15 mol
→ m = mFe + mO + mCu = 0,15. 56 + 0,3 . 16 + 0,15 . 64 + 6,4 = 29,2 (g)




Đáp án C
Cho m gam kim loại Mg, Al tác dụng với 0,25 mol Cu(NO3)2
và 0,5 mol Ag sau phản ứng thu được (m+57,8) gam 2 kim loại chắc chắn là Cu và Ag
Do sinh ra Cu nên Ag hết do vậy thu được 0,5 mol Ag và x mol Cu.
Cho lượng kim loại tác dụng với HNO33 dư thu được 0,3 mol NO
Bảo toàn e: x = 0 , 3 . 3 - 0 , 5 2 = 0 , 2
→ m + 57 , 8 = 0 , 5 . 108 + 0 , 2 . 64
→ m = 9 g a m