Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
X + O2 vừa đủ => Z : NO2 ; N2O ; N2
=> khí T gồm N2O và N2 có M = 40g và n = 0,2 mol
=> nN2O = 0,15 ; nN2 = 0,05 mol
=> nNO = nX – nT = 0,1 mol
NaOH + Y => kết tủa lớn nhất gồm Mg(OH)2 và Al(OH)3
=> mkết tủa – mKL = 39,1 = mOH => nOH = 2,3 mol
Vì nAl : nMg = 5 : 4 => nAl = 0,5 ; nMg = 0,4 mol
Bảo toàn e : 2nMg + 3nAl = 3nNO + 8nN2O + 10nN2 + 8nNH4NO3
=> nNH4NO3 = 0,0375 mol
=> nHNO3 pứ = 10nNH4NO3 + 4nNO + 10nN2O + 12nN2 = 2,875 mol
Thực tế lầy dư axit 20% so với phản ứng => nHNO3 đầu = 3,45 mol
=> mdd HNO3 đầu = 1086,75g
Bảo toàn khối lượng : mKL + mdd HNO3 = mdd sau + mkhí
=> mdd sau = 1098,85g
=> C%Al(NO3)3 = 9,69%

Đáp án : D
.nX = 0,3 mol ; nZ = 0,2 mol
Chỉ có NO phản ứng với O2 tạo NO2 bị hấp thụ vào nước
=> nNO = 0,3 – 0,2 = 0,1 mol
MZ= 40g (Z gồm N2 và N2O )
=> nN2 = 0,05 mol ; nN2O = 0,15 mol
.m(g) P : Mg,Al -> Kết tủa lớn nhất : Mg(OH)2 ; Al(OH)3 : (m + 39,1)g
=> mOH = (m + 39,1) – m = 39,1g => nOH = 2,3 mol = 2nMg + 3nAl
Lại có : nMg : nAl = 4 : 5 => nMg = 0,4 mol ; nAl = 0,5 mol
Bảo toàn e : 2nMg + 3nAl = 10nN2 + 8nN2O + 3nNO + 8nNH4NO3
=> nNH4NO3 = 0,0375 mol
=> Bảo toàn N : nHNO3 pứ = 2nMg + 3nAl + 2nN2 + nNO + 2nN2O + 2nNH4NO3
=> nHNO3 pứ = 2,875 mol
=> nHNO3 đầu = 3,45 mol => mdd HNO3 = 1086,75g
=> mdd sau = mP + mdd HNO3 - mkhí = 1098,85g
=> %CAl(NO3)3 = 9,69%

Đáp án A
Xử lý hỗn hợp khí X: 3 khí đó
chỉ có thể là NO, N2 và N2O.
NO + ½O2 → NO2
và bị giữ lại bởi NaOH.
⇒ Hỗn hợp khí Y chứa
N2 và N2O với
MT.bình = 36 = MT.bình cộng của 2 khí.
⇒ nN2 = nN2O
Đặt nNO = a và nN2 = nN2O = b
Ta có hệ:
a + 2b = 0,04
& 30a + 28b + 44b = 1,32
⇒ a = 0,02 và b = 0,01.
⇒ ∑ne cho nhận
= 3nNO + 10nN2 + 8nN2O = 0,24 mol.
● Đặt số mol 2 kim loại lần lượt là
x và y ta có hệ:
(24+17×2).x + (27+17×3)y = 6,42
& 2x + 3y = 0,24.
⇒ nMg = 0,03 và nAl = 0,06 mol
⇒ mHỗn hợp kim loại = 2,34 gam
+ Bảo toàn nguyên tố Nitơ
⇒ nHNO3 đã pứ = 0,24 + 0,02 + 0,01×2×2
= 0,3 mol.
⇒ ∑nHNO3 ban đầu = 0,3 + 0,3×0,15
= 0,345 mol
⇒ mDung dịch HNO3 = 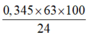
= 90,5625 gam

Đ á p á n B A l F e → 0 , 88 H N O 3 F e 2 + , F e 3 + A l 3 + , N O 3 - N H 4 + , x m o l N O N 2 O + H 2 O n N O + n N 2 O = 0 , 1 3 n N O + 44 n N 2 O = 17 , 1 . 2 . 0 , 1 = 3 , 42 ⇒ n N O = 0 , 07 n N 2 O = 0 , 03 B T N T H : n H 2 O = 0 , 88 - 4 x 2 = 0 , 44 - 2 x B T N T N : n N O 3 - ( Y ) = 0 , 81 - 0 , 3 . 2 - x = 0 , 75 - x B T N T H : 3 . 0 , 88 = 3 0 , 75 - x + 0 , 03 + 0 , 07 + 0 , 44 - 2 x m A l , F e = m m u ố i + m k h í + m H 2 O - m H N O 3 ⇒ x = 0 , 03 m A l , F e = 8 , 22 Y + d d N H 3 → k ế t t ủ a n O H - = 3 n A l 3 + + 3 n F e 3 + + 2 n F e 2 + = 0 , 75 - 0 , 03 - 0 , 03 = 0 , 69 m K T = m K L + m O H - = 8 , 22 + 0 , 69 . 17 = 19 , 95

Đáp án B
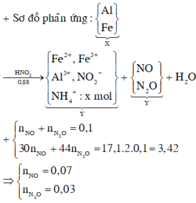
Al, Fe +HNO3 0.88→ MuốiY (Fe3+ (có thể có Fe2+ ) Al3+ +NO3- + NH4+ : xmol
NO: 0,07 và N2O: 0,03
nNO3-= 0,07 . 3 + 0,03 . 8 + 8x + x = 0,45 + 9x
BTNT Nito
0,88 = 0,07 + 0,03 . 2 + x + 9x + 0,45 => x = 0,03
=>nNO3- = 0,72 => NH4NO3 = 0,03
=>nNO3-(KL) = 0.69
nOH- = nNO3-(KL)=0.69
mKl=53,4 - 0,72 . 62 – 0,03 . 18 = 8,22g
cho Y + NH3 => mkt = mKL + mOH- = 8,22 + 0,69 . 17=19,95g

Đáp án : B
,nHNO3 = 0,88 mol ; nZ = 0,1 mol ; MZ = 34,2g
=> nNO = 0,07 ; nN2O = 0,03 mol
Bảo toàn N : nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 => nNH4NO3 = 0,03 mol
=> nNO3 muối KL = 0,69 mol = nOH pứ
Có mhỗn hợp muối = mKL + mNO3 muối KL + mNH4NO3 => mKL = 8,22g
=> mhidroxit = mKL + mOH pứ = 19,95g

Đáp án B
Hỗn hợp khí Y có số mol là 0,14 mol và có M Y = 20 do vậy ta giải được số mol N2O và H2 lần lượt là 0,06 và 0,08 mol.
Khi tác dụng với lượng tối đa NaOH thì kết tủa ta thu được chỉ có Mg(OH)2 nung kết tủa thu được chất rắn là MgO → n M g O = 0 , 24 m o l
Gọi số mol AlCl3 trong dung dịch là a mol , NaCl là b mol, NH4Cl là c mol và MgCl2 là 0,24 mol.

13,52+85b+1,08.36,5 = 133,5a+58,5b+53,5c+0,24.95+0,06.44+0,08.2+18.(0,46-2c)
Giải hệ: a = 0,16; b = 0,1; c = 0,02.
Bảo toàn O:
![]()
![]()
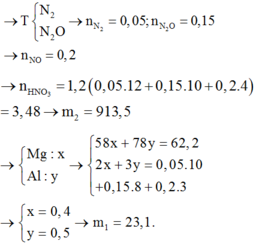

Đáp án : B
n hh X = 6,72: 22,4 = 0,3 mol
n hh Z = 4,48 : 22,4 = 0,2 mol
M ¯ hh Z = 20.2 = 40
Z gồm N2 và N2O
=> n N2 = 0,05 mol
n N2O = 0,15 mol
=> n NO = n X – n Z = 0,1 mol
Mặt khác, có hh A (Mg, Al) => Kết tủa chứa Al(OH)3 và Mg(OH)2
m → m+ 39,1
Gọi n Mg = a mol => n Al = 1,25a mol
m hh A = 24a + 33,75a = 57,75 a = m
m↓ = 58a + 97,5 a = 57,75a + 39,1
<=> a = 0,4 mol
=> n Mg = 0,4; n Al = 0,5 mol
Mg → Mg+2 + 2e
0,4 0,8
Al → Al+3 + 3e
0,5 1,5
N+5 + 10e → N2
0,5 0,05
N+5 + 8e → N-3
8a a
N+5 + 3e → N+2
0,3 0,1
2N+5 + 8e → N2O
1,2 0,15
Bảo toàn electron, ta có: 0,8 + 1,5 = 0,3 + 1,2 + 0,5 + 8a
<=> 8a = 0,3
<=> a = 0,0375 mol
=> ∑ n HNO3p.ư = n NO3 – (muối của KL) + n N(sp khử) + 2 n NH4NO3
= 2,3 + 0,1 + 0,15. 2 + 0,05. 2 + 0,0375. 2
= 2,875 mol
=> n HNO3 t.t = 3,45 mol => mdd HNO3 = (3,45. 63)/ 0,2 = 1086,75 g
=> m dd sau p.ư = m KL + m HNO3 – n khí
= 0,4. 24 + 0,5. 27 + 1086,75 – 0,1. 30 – 0,05. 28 – 0,15. 44
= 1098,85 gam
C% Al(NO3)3 = 106,5 : 1098,85 = 9,7%