

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
Ta có N2O4 (không màu, k) <=> 2NO2 (màu nâu đỏ, k) ∆H = 58kJ > 0
Khi ngâm ống 1 trong nước đá → giảm nhiệt độ → cân bằng chuyển dịch theo chiều nghịch (chiều phản ứng tỏa nhiệt)
→ Ống 1 có màu nhạt hơn → Chọn A.

Chọn B
Ở nhiệt độ t 2 hỗn hợp khí có tỉ khối hơi so với H 2 lớn hơn nhiệt độ t 1 → ở nhiệt độ t 2 có lượng N 2 O 4 lớn hơn ở nhiệt độ t 1 .
Mà t 1 > t 2 → khi giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận (tạo thành N 2 O 4 không màu); khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch (tạo thành N O 2 màu nâu).

A
Khi ngâm bình chứa N O 2 vào chậu nước đá tức giảm nhiệt độ của hệ phản ứng cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt.
Lại có chiều thuận là chiều làm nhạt màu khí trong bình.
→ Chiều thuận là chiều phản ứng tỏa nhiệt.

Chọn D
Ở ống (4) vừa tăng diện tích tiếp xúc của chất phản ứng vừa tăng nhiệt độ phản ứng → khí thoát ra nhanh nhất.

- Ta có phương trình: HCl + CaCO3 → CaCl2 + CO2↑ + H2O
=> Khi cho mẩu đá vôi tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là carbon dioxide
- Nồng độ HCl càng cao thì tốc độ phản ứng diễn ra càng nhanh.
- Giải thích: để phản ứng xảy ra, cần phải có sự va chạm giữa HCl và CaCO3. Ở ống nghiệm 2, nồng độ HCl lớn gấp đôi ở ống nghiệm 1, do vậy số va chạm của HCl và CaCO3 (trong cùng 1 đơn vị thời gian) sẽ lớn hơn, từ đó tốc độ phản ứng ở ống nghiệm 2 là lớn hơn

Sau khi nhỏ nhanh vài giọt bromine vào ống nghiệm chứa nước, dung dịch bromine có những chất: Br2, H2O, HBr, HBrO.
Br2(aq) + H2O(l) \( \rightleftharpoons \) HBr(aq) + HBrO(aq)
- Vì phản ứng xảy ra thuận nghịch nên trong dung dịch có cả chất tham gia và chất sản phẩm

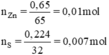
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S 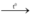 ZnS
ZnS
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

Đáp án D
Phương trình phản ứng: MnO 2 + 4 HCl → MnCl 2 + Cl 2 ↑ + 2 H 2 O
Khí Cl2 thu được thường lẫn khí hidro clorua (khí HCl) và hơi nước. Sau khi đã loại bỏ khí HCl thì khí Cl2 còn lẫn hơi H2O
Khi đóng khoá K thì khí Cl2 lẫn hơi H2O sẽ phải đi qua H2SO4 đặc, khí thu được sau khi qua H2SO4 đặc là khí Cl2 khô (H2SO4 đặc có tính háo nước nên đã hấp thụ H2O). Khí Cl2 không tẩy được màu, do đó miếng giấy không mất màu.
Khi mở khoá K thì khí Cl2 có lẫn hơi H2O (khí Cl2 ẩm) sẽ đi đến miếng giấy màu mà không qua H2SO4 đặc, do đó miếng giấy mất màu vì Cl2 ẩm có tính tẩy màu:
Cl 2 + H 2 O ⇄ HCl + HClO
HClO là chất oxi hoá mạnh => HClO có tính tẩy màu, sát trùng,…
=> Cl2 ẩm có tính tẩy màu, sát trùng,…
Vậy phát biểu D sai.

Khi giảm nhiệt độ bình cân bằng chuyển dịch theo chiều thuận. Tức phản ứng thuận là phản ứng tỏa nhiệt, phản ứng nghịch là thu nhiệt.
Do đó, phản ứng thuận là thu nhiệt là sai. Chọn B