Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ag+ + Cl- -> AgCl
Banđầu: 0,2. 0,05
Pư :. 0,05. 0,05.-> 0,05
Sau pư : 0,15. 0. 0,05
mAgCl=0,05.143,5=7,175g
=> A

Đáp án C
n↓=nAgCl=nCl-=x=17,22/143,5=0,12 mol.
BTĐT: 3nAl3+ + 2nMg2+ + 2nCu2+ = nNO3- + nCl-
=>3.0,02+0,04.2+2y=0,04+0,12
=>y=0,01
Mg2++ 2OH-→ Mg(OH)2
0,04→ 0,08 0,04
Cu2+ + 2OH- → Cu(OH)2
0,01→ 0,02 0,01
Al3+ + 3OH- → Al(OH)3
0,02→ 0,06 0,02
Al(OH)3 + OH- → AlO2- + H2O
0,01← 0,17-0,16
Vậy kết tủa gồm: 0,04 mol Mg(OH)2; 0,01 mol Cu(OH)2; 0,01 mol Al(OH)3.
=> m = 4,08 gam.
Đáp án C


Còn lại 0,01 mol OH- dư hòa tan bớt 0,01 mol Al(OH)3
Vậy m = 0,01.98 + 0,04.58 + 0,01.78 = 4,08
Đáp án C

Đáp án C
Ta có x = nCl- = nAgCl = 0,12 mol
Áp dụng ĐLBT ĐT với dung dịch X nên y = 0,01 mol
Al3++ 3OH-→ Al(OH)3
0,02 0,06 0,02
Mg2++ 2OH-→ Mg(OH)2
0,04 0,08 0,04
Cu2++ 2OH-→ Cu(OH)2
0,01 0,02 0,01
Al(OH)3+ OH- → AlO2-+ H2O
0,02 0,01
Kết tủa sau phản ứng có Al(OH)3: 0,01 mol và Mg(OH)2: 0,04 mol; Cu(OH)2: 0,01 mol
Nên m = 0,01.78+ 0,04.58+ 0,01.98 = 4,08 gam

Theo định luật bảo toàn điện tích:
\(a+b=n_{Na^+}+2n_{Mg^{2+}}\Rightarrow a+b=0,4\) (1)
Để đơn giản, ta xét toàn bộ lượng dung dịch X tác dụng với dung dịch AgNO3 dư, ta có:
\(n_{AgCl}=\dfrac{2,1525.10}{143,5}=0,15\left(mol\right)\)
\(Ag^++Cl^-\rightarrow AgCl\downarrow\)
0,15 <-- 0,15
\(\Rightarrow a=n_{Cl^-}=0,15\left(mol\right)\Rightarrow b=0,4-0,15=0,25\left(mol\right)\)
Muối khan thu được khi cô cạn dung dịch X là:
\(m_{\text{muối}}=0,1.23+0,15.24+0,15.35,5+0,25.62=26,725\left(gam\right)\)
Theo định luật bảo toàn điện tích:
\(a+b=n_{Na^+}+2n_{Mg^{2+}}\Rightarrow a+b=0,4\) (1)
Để đơn giản, ta xét toàn bộ lượng dung dịch X tác dụng với dung dịch AgNO3 dư, ta có:
\(n_{AgCl}=\dfrac{2,1525.10}{143,5}=0,15\left(mol\right)\)
\(Ag^++Cl^-\rightarrow AgCl\downarrow\)
0,15 <-- 0,15
\(\Rightarrow a=n_{Cl^-}=0,15\left(mol\right)\Rightarrow b=0,4-0,15=0,25\left(mol\right)\)
Muối khan thu được khi cô cạn dung dịch X là:
\(m_{\text{muối}}=0,1.23+0,15.24+0,15.35,5+0,25.62=26,725\left(gam\right)\)

Chọn B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
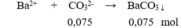
m↓ = 0,075.197 = 14,775 gam.

Bảo toàn điện tích :
\(3a+2b=0.08+0.16=0.24\left(1\right)\)
\(Fe^{2+}+Ag^+\rightarrow Fe^{3+}+Ag\)
\(b.........................b\)
\(m\downarrow=108b+0.08\cdot143.5=21.2\left(g\right)\)
\(\Rightarrow b=0.09\)
\(\left(1\right):a=0.02\)
\(Fe^{2+}+2OH^-\rightarrow Fe\left(OH\right)_2\)
\(Fe^{3+}+2OH^-\rightarrow Fe\left(OH\right)_3\)
\(m\downarrow=0.09\cdot90+0.02\cdot107=10.24\left(g\right)\)

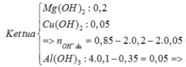

$Ag^+ + Cl^- \to AgCl$
n Cl- = n AgCl = 86,1/143,5 = 0,6(mol)
Bảo toàn điện tích :
n Cu2+ = (0,6 + 0,2 - 0,1.3 + 0,2.2 )/2 = 0,05(mol)
Bảo toàn nguyên tố Fe,Cu,Mg , Kết tủa gồm :
Fe(OH)3 : 0,1 mol
Mg(OH)2 : 0,2(mol)
Cu(OH)2: 0,05(mol)
=> m kết tủa = 0,1.107 + 0,2.58 + 0,05.98 = 27,2 gam
Đáp án A
Ủa đề có thiếu không bạn oii!